Ферменты
Ферменты (энзимы) — это биологические катализаторы белковой природы, обладающие способностью активизировать различные химические реакции, происходящие в живом Организме.
Образуются ферменты в любой живой клетке и могут проявлять активность вне ее. Действие ферментов строго специфично, т. е. каждый фермент катализирует только одну или несколько близких химических реакций. Поэтому название их складывается из названия вещества, на которое они действуют, и окончания «аза». Например, фермент, расщепляющий сахарозу, называют сахаразой, лактозу — лактазой. Ферменты обладают очень большой активностью. Ничтожной дозы их достаточно для превращения огромного количества вещества из одного состояния в другое. Ферменты характеризуются определенными свойствами. Так, некоторые ферментативные процессы обратимы, т. е. в зависимости от условий одни и те. же ферменты могут ускорять как процесс распада, так и процесс синтеза вещества.
Ферменты играют важную роль в производстве продовольственных товаров, в процессе их хранения и кулинарной обработки. Для изготовления сыров используют сычужные ферменты. В производстве кисломолочных продуктов, квашеных овощей и брожении теста участвуют ферменты, которые выделяют бактерии и дрожжи. Ферменты существенно влияют на качество продуктов. В одних случаях это влияние положительно, например созревание мяса после убоя животных и сельди и лососевых рыб при посоле, в других случаях — отрицательно, например потемнение яблок, картофеля при очистке и нарезке. Под действием ферментов окисляются жиры. Прокисание супов, гниение фруктов, брожение компотов и варенья вызывают ферменты, выделяемые попавшими в пищу микробами. Для прекращения отрицательного действия ферментов применяют нагревание или понижение температуры хранения продуктов.
По современной классификации все ферменты делят на шесть классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изоме-разы, лигазы (синтетазы). Каждый класс подразделяют на подклассы, а каждый подкласс — на группы.
Оксидоредуктазы. Это ферменты, катализирующие окислительно-восстановительные реакции, которые протекают в живых организмах.
В классе оксидоредуктаз основное значение имеют дегидрогеназы, которые осуществляют реакцию дегидрирования. Все дегидрогеназы делят на две группы: анаэробные и аэробные, которые называют оксидазами.
Анаэробные дегидрогеназы представляют собой специфические ферменты, катализирующие отщепление водорода от определенных химических веществ и передающие его другим ферментам — переносчикам водорода. Так, лактатдегидрогеназа катализирует реакцию окисления молочной кислоты до пировиноградной, изоцитратдегид-рогеназа — окисление изолимонной кислоты до щавелево-янтарной.
К группе аэробных дегидрогеназ (оксидаз) относят ферменты, в состав которых в качестве кофермента входит витамин В2 (рибофлавин), поэтому их называют флавиновыми ферментами. Они способны отнимать водород от окисляемого вещества и передавать его другим соединениям или кислороду воздуха. К этой группе ферментов относятся полифенолоксидаза, аскорбинатоксидаза, глкжо-оксидаза.
Они способны отнимать водород от окисляемого вещества и передавать его другим соединениям или кислороду воздуха. К этой группе ферментов относятся полифенолоксидаза, аскорбинатоксидаза, глкжо-оксидаза.
Трансферазы, или ферменты переноса. Они ускоряют перенос целых атомных групп от одного соединения к другому. Трансферазы имеют огромное значение для обмена веществ в живых организмах. В зависимости от характера переносимых группировок различают аминотрансферазы, фосфортрансферазы, глюкозилтрансферазы, ацилтрансферазы и др.
Аминотрансферазы ускоряют реакцию переаминирования аминокислот с кетокислотами.
Фосфортрансферазы ускоряют перенос остатков фосфорной кислоты на спиртовые, карбоксильные, азотсодержащие и другие группы тех или иных органических соединений.
Глюкозилтрансферазы катализируют реакции переноса глюкозидных остатков с молекул фосфорных эфиров или других соединений к молекулам моносахаридов, полисахаридов или других веществ.
Гидролазы. Эти ферменты катализируют гидролиз, а иногда и синтез органических соединений при участии воды.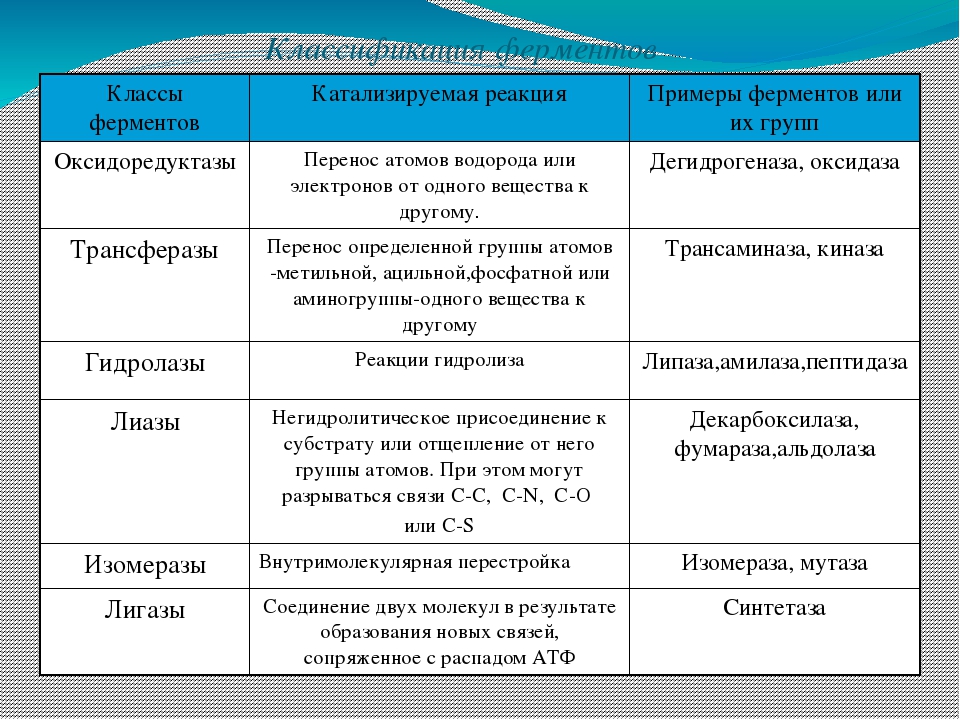
Эстеразы ускоряют реакции гидролиза и синтеза сложных эфиров. К ним относятся липазы, лецитиназы и другие ферменты.
Карбогидразы расщепляют глюкозидные связи в углеводах и их производных. К ним относятся мальтаза, лактаза, пектиназа и др.
Амидазы ускоряют гидролиз амидов кислот. К ним относятся пурин- и пирамидиндезаминазы, ациламидазы, амидиназы и др.
Пептидазы катализируют реакции расщепления белка и полипептидов.
Лиазы. Они объединяют ферменты, ускоряющие негидротические реакции распада органических веществ с отщеплением воды, углекислого газа или аммиака и др. Некоторые из этих реакций обратимы, и соответствующие ферменты при определенных условиях катализируют реакции не только распада, но и синтеза.
Изомеразы. Они катализируют превращение органических соединений в их изомеры. В отличие от трансферазы измеразы катализируют перенос групп только внутри молекул. Эти превращения могут состоять во внутримолекулярном переносе водорода, фосфатных и ацетильных групп, в изменении пространственного расположения атомных группировок, в перемещении двойных связей. Изомеразы играют важную роль в обмене веществ.
В отличие от трансферазы измеразы катализируют перенос групп только внутри молекул. Эти превращения могут состоять во внутримолекулярном переносе водорода, фосфатных и ацетильных групп, в изменении пространственного расположения атомных группировок, в перемещении двойных связей. Изомеразы играют важную роль в обмене веществ.
Лигазы (синтетазы). Это большая группа ферментов, ускоряющих синтез сложных органических соединений из более простых. Реакция синтеза требует значительной затраты энергии, поэтому активность лигаз проявляется лишь в присутствии таких макроэнергетических соединений, как аденозинтрифосфорная кислота (АТФ) или другой нуклеотидтрифосфат. При отрыве от молекул АТФ в присутствии лигаз одного или двух концевых остатков фосфорной кислоты выделяется большое количество энергии, используемой для активирования реагирующих веществ.
Ферменты способны осуществлять каталитические функции вне клетки и вне организма, поэтому для практических целей представляет большой интерес выделение ферментов и их использование в пищевой, легкой, медицинской и некоторых других отраслях промышленности, на предприятиях общественного питания.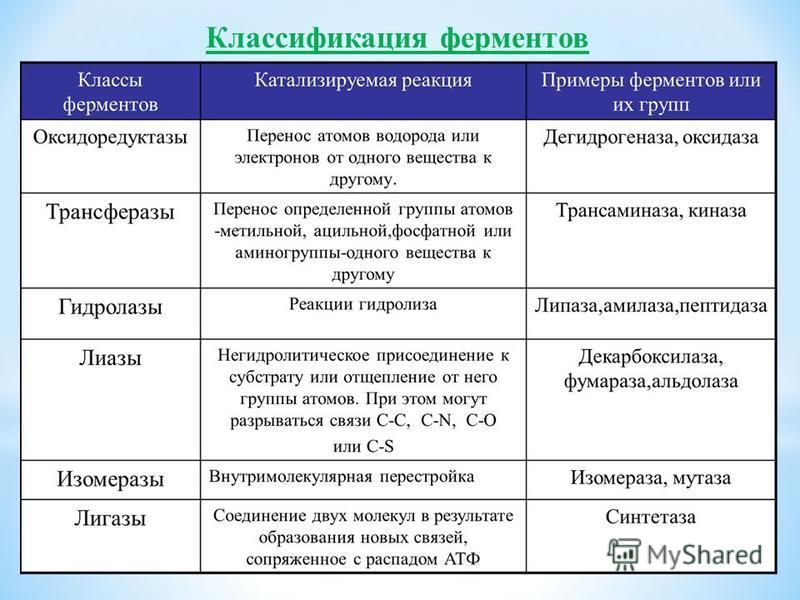
Классификация ферментов
В настоящее время известно более 4000 ферментов. Их разделяют на шесть классов в зависимости от типа катализируемой реакции. Классы разделяются на подклассы, на под-подклассы и, наконец, на отдельные ферменты. Каждый фермент имеет шифр, состоящий из четырех чисел.
Первый класс ферментов называется оксидоредуктазы. К нему относятся ферменты, катализирующие окислительно-восстановительные реакции.
Окислительно-восстановительные процессы в клетке могут осуществляться тремя путями: переносом иона водорода, присоединением кислорода и переносом электронов.
Наиболее распространенными оксидоредуктазами являются дегидрогеназы, осуществляющие перенос водорода. В состав дегидрогеназ могут входить в качестве кофермента НАД+ (никотинамид аденин дину клеотид) или НАДФ+ (никотинамидаденинди-нуклеотидфосфат), а также ФАД (флавинадениндинуклеотид) или ФМН (флавинмононуклеотид).
Дегидрогеназы играют важную роль в таких процессах, как фотосинтез, брожение и дыхание. Дегидрогеназы катализируют ряд реакций цикла Кребса. Алкогольдегидрогеназа и лактатдегидрогеназа участвуют, соответственно, в спиртовом и молочнокислом брожении.
Биологическое окисление, связанное с переносом водорода и осуществляемое при участии дегидрогеназ, сопровождается высвобождением энергии, которая запасается в клетках в виде АТФ.
Оксидоредуктазы, для которых акцептором водорода служит только кислород воздуха, называют оксидазами.
Среди оксидоредуктаз важное значение имеют еще два фермента — каталаза и пероксидаза. Оба эти фермента разрушают ядовитую для живой клетки перекись водорода.
Оксидоредуктазы, катализирующие реакции присоединения к окисляемому субстрату кислорода воздуха, называются оксигеназами. К ним относится, например, фермент липоксигеназа, который катализирует окисление кислородом воздуха ненасыщенных высокомолекулярных жирных кислот.
К ним относится, например, фермент липоксигеназа, который катализирует окисление кислородом воздуха ненасыщенных высокомолекулярных жирных кислот.
Второй класс ферментов называется трансферазы. Это ферменты, которые катализируют реакции переноса каких-либо химических групп с одного вещества на другое. Существует несколько подклассов трансфераз, например:
- гликозилтрансферазы — ферменты, которые переносят остатки моносахаридов, например, глюкозы, с одного вещества на другое;
- аминотрансферазы — ферменты, катализирующие реакции переноса аминогрупп, например, в реакциях переаминирования между аминокислотами и кетокислотами.
Третий класс ферментов называется гидролазы. Сюда относят ферменты, катализирующие реакции гидролиза сложных органических веществ. При гидролизе вода присоединяется по месту разрыва химической связи. Наиболее важные подклассы гидролаз — это эстеразы, гликозидазы и пептидгидролазы.
Эстеразы — это ферменты, осуществляющие гидролиз по сложноэфирной связи; в результате образуются спирт и органическая кислота.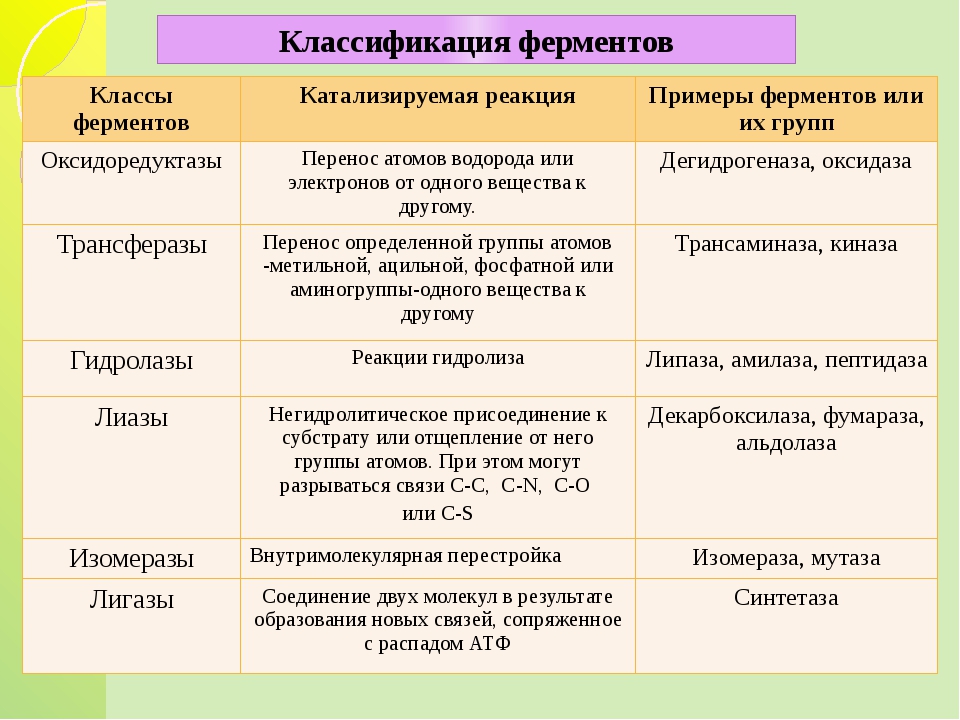 Среди эстераз наибольшее значение имеет фермент липаза, которая катализирует гидролиз жиров.
Среди эстераз наибольшее значение имеет фермент липаза, которая катализирует гидролиз жиров.
Гликозидазы — это ферменты, гидролизующие ди-, три — и полисахариды по гликозидным связям. К наиболее значимым гликозидазам можно отнести: β-фруктофуранозидазу, которая осуществляет гидролиз сахарозы; α-глюкозидазу, которая гидролизует мальтозу; α-амилазу и β-амилазу, гидролизующие крахмал.
Пептидгидролазы (протеазы) — это ферменты, которые гидролизуют пептиды и белки, расщепляя в них пептидные связи. Они разделяются на две группы: пептидазы и протеиназы. Пептидазы осуществляют гидролиз концевых пептидных связей в белках и пептидах. Протеиназы гидролизуют полипептиды, расщепляя в них глубинные пептидные связи.
Таким образом, гидролиз белка осуществляется при совместном действии протеиназ и пептидаз. Промежуточными продуктами гидролиза являются различные пептиды, а конечными — свободные аминокислоты.
Среди протеиназ важное место занимают трипсин, пепсин и папаин.
Трипсин вырабатывается поджелудочной железой. Оптимум активности фермента находится в щелочной среде (рН 8-9). Трипсин осуществляет гидролиз, в основном, тех пептидных связей в молекулах белка, которые образованы за счет карбоксильных групп аминокислот лизина или аргинина.
Оптимум активности фермента находится в щелочной среде (рН 8-9). Трипсин осуществляет гидролиз, в основном, тех пептидных связей в молекулах белка, которые образованы за счет карбоксильных групп аминокислот лизина или аргинина.
Пепсин вырабатывается стенками желудка. Оптимум его активности лежит в сильнокислой среде (рН 1,2-1,5). Пепсин может гидролизовать в белках пептидные связи, образованные аминными группами аминокислот тирозина и фенилаланина.
Папаин — фермент растительного происхождения, он не обладает высокой специфичностью действия. Особенностью папаина является то, что он активируется соединениями, содержащими сульфгидрильную группу, например, цистеином или восстановленной формой глутатиона. Отличительной чертой папаина является способность сохранять свою
Ферментативную активность в широком интервале температур и рН среды.
Пептидазы подразделяются на три подподкласса: аминопептидазы, карбоксипептидазы и дипептидазы.
Аминопептидазы гидролизуют пептидную связь, расположенную рядом с α-аминогруппой.
Карбоксипептидазы гидролизуют ту пептидную связь, которая находится рядом с α-карбоксильной группой.
Дипептидазы осуществляют гидролиз дипептидов; при этом образуются свободные аминокислоты.
Четвертый класс ферментов называется лиазы. Это ферменты, катализирующие реакции негидролитического расщепления. В результате их действия образуются двойные связи. Лиазы катализируют также присоединение химических групп к двойным связям. Примером фермента класса лиаз может служить пируватдекарбоксилаза, которая катализирует реакцию отщепления CO2 от пировиноградной кислоты.
Пятый класс ферментов — изомеразы. Это ферменты, которые катализируют изомеризацию различных органических соединений. Например, фермент глюкозофосфатизомераза катализирует взаимное превращение глюкозо-6-фосфата и фруктозо-6-фосфата:
Глюкозо-6-фосфат → фруктозо-6-фосфат
Шестой класс ферментов — лигазы (синтетазы). Это ферменты, катализирующие соединение друг с другом двух молекул, сопряженное с гидролизом высокоэнергетической связи в молекуле АТФ. К шестому классу ферментов относится глутаминсинтетаза, которая катализирует следующую реакцию.
К шестому классу ферментов относится глутаминсинтетаза, которая катализирует следующую реакцию.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
5. Классификация ферментов и характеристика некоторых групп
По
первой в истории изучения ферментов
классификации их делили на две группы: гидролазы,
ускоряющие гидролитические реакции,
и десмолазы,
ускоряющие реакции негидролитического
распада. Затем была сделана попытка
разбить ферменты на классы по числу
субстратов, участвующих в реакции. В
соответствии с этим ферменты
классифицировали на три группы. 1. Катализирующие превращения двух
субстратов одновременно в обоих
направлениях: А+В)С+D. 2. Ускоряющие превращения двух субстратов
в прямой реакции и одного в обратной:
А+В)С. 3. Обеспечивающие каталитическое
видоизменение одного субстрата как в
прямой, так и в обратной реакции: А)В.
Одновременно развивалось направление, где в основу классификации ферментов был положен тип реакции, подвергающейся каталитическому воздействию. Наряду с ферментами, ускоряющими реакции гидролиза (гидролазы), были изучены ферменты, участвующие в реакциях переноса атомов и атомных групп (феразы), в изомеризации (изомеразы), расщеплении (лиазы), различных синтезах (синтетазы) и т. д. Это направление в классификации ферментов оказалось наиболее плодотворным, так как объединяло ферменты в группы не по надуманным, формальным признакам, а по типу важнейших биохимических процессов, лежащих в основе жизнедеятельности любого организма. По этому принципу все ферменты делят на 6 классов.
1.
Оксидоредуктазы — ускоряют реакции окисления —
восстановления. 2.
Трансферазы — ускоряют реакции переноса функциональных
групп и молекулярных остатков. 3.
Гидролазы — ускоряют реакции гидролитического
распада. 4.
Лиазы — ускоряют негидролитическое отщепление
от субстратов определенных групп атомов
с образованием двойной связи (или
присоединяют группы атомов по двойной
связи).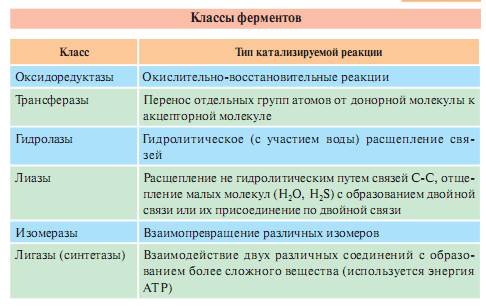 5.
Изомеразы — ускоряют пространственные или
структурные перестройки в пределах
одной молекулы. 6.
Лигазы — ускоряют реакции синтеза, сопряженные
с распадом богатых энергией связей.
Эти классы и положены в основу новой
научной классификации ферментов.
5.
Изомеразы — ускоряют пространственные или
структурные перестройки в пределах
одной молекулы. 6.
Лигазы — ускоряют реакции синтеза, сопряженные
с распадом богатых энергией связей.
Эти классы и положены в основу новой
научной классификации ферментов.
К классу оксидоредуктаз относят ферменты, катализирующие реакции окисления — восстановления. Окисление протекает как процесс отнятия атомов Н (электронов) от субстрата, а восстановление — как присоединение атомов Н (электронов) к акцептору.
В
класс трансфераз входят ферменты,
ускоряющие реакции переноса функциональных
групп и молекулярных остатков от одного
соединения к другому. Это один из
наиболее обширных классов: он насчитывает
около 500 индивидуальных ферментов. В
зависимости от характера переносимых
группировок различают фосфотрансферазы,
аминотрансферазы, гликозилтрансферазы,
ацилтрансферазы, трансферазы, переносящие
одноуглеродные остатки (метилтрансферазы,
формилтрансферазы), и др. Например,
амидазы ускоряют гидролиз амидов
кислот. Из них важную роль в биохимических
процессах в организме играют уреаза,
аспарагиназа и глутаминаза.
Например,
амидазы ускоряют гидролиз амидов
кислот. Из них важную роль в биохимических
процессах в организме играют уреаза,
аспарагиназа и глутаминаза.
Уреаза была одним из первых белков-ферментов, полученным в кристаллическом состоянии. Это однокомпонентный фермент (М=480000), молекула его глобулярна и состоит из 8 равных субъединиц. Уреаза ускоряет гидролиз мочевины до NН3 и СО2.
Характерные черты действия ферментов класса лигаз (синтетаз) выявлены совсем недавно в связи со значительными успехами в изучении механизма синтеза жиров, белков и углеводов: Оказалось, что старые представления об образовании этих соединений, согласно которым они возникают при обращении реакций гидролиза, не соответствуют действительности. Пути их синтеза принципиально иные.
Главная
их особенность — сопряженность синтеза
с распадом веществ, способных поставлять
энергию для осуществления биосинтетического
процесса. Одним из таких природных
соединений является АТФ. При отрыве от
ее молекулы в присутствии лигаз одного
или двух концевых остатков фосфорной
кислоты выделяется большое количество
энергии, используемой для активирования
реагирующих веществ. Лигазы же
каталитически ускоряют синтез
органических соединений из активированных
за счет распада АТФ исходных продуктов.
Таким образом, к лигазам относятся
ферменты, катализирующие соединение
друг с другом двух молекул, сопряженное
с гидролизом пирофосфатной связи в
молекуле АТФ или иного нуклеозидтрифосфата.
При отрыве от
ее молекулы в присутствии лигаз одного
или двух концевых остатков фосфорной
кислоты выделяется большое количество
энергии, используемой для активирования
реагирующих веществ. Лигазы же
каталитически ускоряют синтез
органических соединений из активированных
за счет распада АТФ исходных продуктов.
Таким образом, к лигазам относятся
ферменты, катализирующие соединение
друг с другом двух молекул, сопряженное
с гидролизом пирофосфатной связи в
молекуле АТФ или иного нуклеозидтрифосфата.
Механизм действия лигаз изучен еще недостаточно, но, несомненно, он весьма сложен. В ряде случаев доказано, что одно из участвующих в основной реакции веществ сначала дает промежуточное соединение с фрагментом распадающейся молекулы АТФ, а вслед за этим указанный промежуточный продукт взаимодействует со вторым партнером основной химической реакции с образованием конечного продукта.
Пищевые ферменты
Динамическое развитие биотехнологий и научные открытия в области энзимологии сделали ферментные препараты незаменимым элементом многих пищевых технологий. Использование ферментов позволяет повышать скорость технологических процессов, ощутимо увеличивать выход готовой продукции, улучшать ее качество, экономить ценное сырье и снижать количество отходов.
Использование ферментов позволяет повышать скорость технологических процессов, ощутимо увеличивать выход готовой продукции, улучшать ее качество, экономить ценное сырье и снижать количество отходов.
Для получения ферментных препаратов пищевого назначения используются органы и ткани сельскохозяйственных животных, культурные растения, специальные штаммы микроорганизмов (плесневых грибов, бактерий).
Ферментные препараты микробного происхождения получают при культивировании специфических микроорганизмов, способных вырабатывать определенные ферменты. В настоящее время большинство ферментов в промышленности получают, используя бактерии и плесневые грибы в специальных аппаратах биореакторах (ферментерах) в жестко контролируемых условиях. Различают ферментные препараты бактериальные, полученные путем глубинного культивирования бактерий, и грибные, полученные путем поверхностного культивирования микроскопических грибов.
В технологии пищевых продуктов применяются ферментные препараты с амилолитической, протеолитической, липолитической, пектолитической, оксидазной активностью. Они используются в пивоварении, виноделии, хлебопечении, при производстве спирта, фруктовых и овощных соков, дрожжей, сыра, творога, мясо- и рыбопродуктов, белковых гидролизатов, инвертного сиропа, при переработке крахмала.
Они используются в пивоварении, виноделии, хлебопечении, при производстве спирта, фруктовых и овощных соков, дрожжей, сыра, творога, мясо- и рыбопродуктов, белковых гидролизатов, инвертного сиропа, при переработке крахмала.
Современные технологии позволяют расширить сферу применения ферментных препаратов. На сегодняшний день можно насчитать около 15 отраслей пищевой промышленности, где с успехом используют ферменты, причем в каждой отрасли отдельная группа ферментов обеспечивает достижение конкретных целей, позволяющих либо улучшить качество продукта, либо увеличить выход данной продукции или удешевить процесс, а значит, снизить себестоимость продукции.
Производство муки и хлебопечение
Качество хлеба определяется особенностями химического состава муки и активностью ее ферментного комплекса. Получить хлеб хорошего качества можно только в том случае, когда в процессе тестоведения гармонически сочетаются скорости микробиологических процессов и биохимических превращений.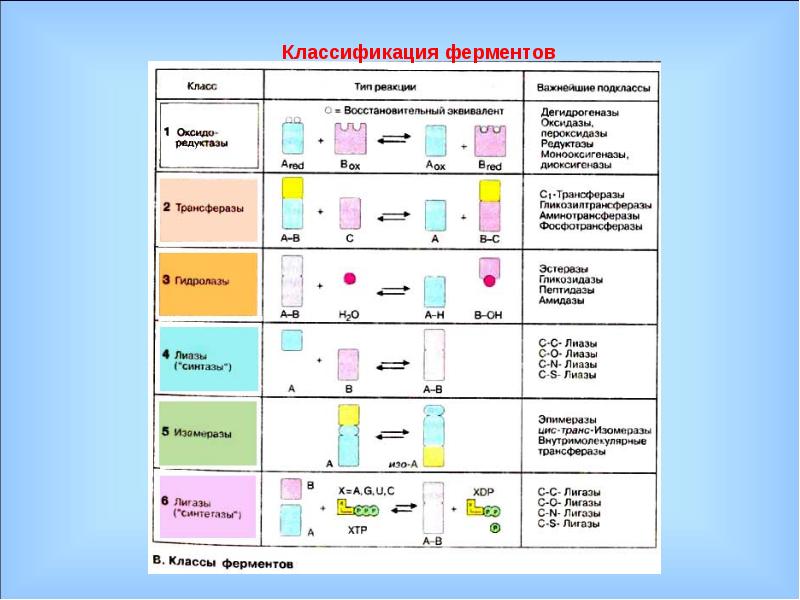 Ферментативный гидоолиз высокомолекулярных компонентов сырья (белков и углеводов) в определенной степени способствует интенсификации этих превращений и, в конечном счете, положительно сказывается на качестве хлеба.
Ферментативный гидоолиз высокомолекулярных компонентов сырья (белков и углеводов) в определенной степени способствует интенсификации этих превращений и, в конечном счете, положительно сказывается на качестве хлеба.
Эффективность использования тех или иных ферментных препаратов в хлебопечении в значительной степени зависит от качества муки. Хлебопекарные свойства муки, в особенности качество клейковины и активность собственных ферментов, определяют требования к ферментным препаратам.
Ферменты для хлебопечения используют в виде добавок к муке и в составе разрыхлителей теста для компенсации низких качественных показателей муки, улучшения структуры теста и качественных характеристик готового изделия. В хлебопечении применяют в основном пять ферментных препаратов.
Улучшение клейковинного каркаса: Протеаза, Ксиланаза, Глюкозооксидаза, Липаза.
Увеличение газоудерживающей способности теста и объёма хлеба: Альфа-амилаза, Ксиланаза, Глюкозооксидаза, Липаза.
Улучшение цвета, вкуса и аромата: Альфа-амилаза, Липаза.
Улучшение структуры мякиша: Альфа-амилаза, Ксиланаза, Глюкозооксидаза, Липаза.
Увеличение срока хранения: Альфа-амилаза.
Кондитерское производство
Кондитерские изделия в зависимости от вида сырья и типа технологического процесса подразделяют на две группы: мучные и сахаристые. К мучным изделиям относятся печенье, галеты, крекеры, вафли, пряники, кексы, пирожные, рулеты, торты и т.п.. К сахаристым — какао-порошок, шоколад, конфеты, карамель, мармелад, пастила, ирис, драже, халва и т.п..
При производстве мучных кондитерских изделий с использованием дрожжей, таких как галеты, крекеры, кексы, целесообразно применение комплексных препаратов с преобладанием протеолитического действия, но содержащих в своем составе и альфа-амилазу. Совокупное действие этих ферментов обеспечивают дрожжи сбраживаемыми сахарами и низкомолекулярными азотистыми веществами.
При производстве затяжного печенья с использованием химических разрыхлителей, когда много усилий направляется на расслабление клейковины, на протяжении длительного технологического процесса наряду с механическим воздействием на белки клейковины целесообразно использование протеолитических ферментных препаратов.
Для заварных и сырцовых пряников наибольшее значение имеет протеолиз, но наряду с потребностью в регулируемом расслаблении теста важным является и сохранение свежести (мягкости) продукта. При производстве таких видов изделий целесообразно применение комплексных ферментных препаратов с преобладанием протеолитической активности.
При производстве бисквитного полуфабриката нужны комплексные ферментные препараты с умеренной активностью протеолитических ферментов и невысокой альфа-амилазной (дексгринирующей) способностью. При таком сочетании обеспечивается умеренное расслабление клейковины, способствующее лучшему подъему теста при выпечке и образованию тонкопористой воздушной структуры готовых изделий. Образование декстринов, в свою очередь, способствует сохранению их свежести.
Образование декстринов, в свою очередь, способствует сохранению их свежести.
Комплексные ферментные препараты, содержащие протеазы и альфа-амилазу, используются для ускорения и облегчения обработки теста при приготовлении слоеного полуфабриката с целью улучшения его эластичных свойств и предупреждения усадки при выпечке. Применение таких ферментных препаратов при производстве вафель позволяет оптимально снизить вязкость вафельного теста, способствует получению тонких хрустящих вафельных листов.
Для производства отливных помадных корпусов конфет, круглых помадных корпусов и жидких фруктовых начинок, таких как вишневый ликер, в кондитерской промышленности применяется фермент Инвертаза. Применение Инвертазы обусловлено необходимостью получить полумягкую или жидкую консистенцию при высоких концентрациях сахара, предотвращающих брожение. Ускорение или замедление действия инвертазы достигается путем изменения концентрации вносимого препарата, количества воды и температурного режима.
Переработка фруктов, ягод, овощей
Наряду с современным оборудованием и новыми технологическими процессами, при переработке фруктов, ягод и овощей, ферменты позволяют повысить глубину переработки сырья и тем самым уменьшить количество отходов, повышают производительность и рентабельность предприятий. При этом в одних случаях необходимо иметь набор ферментных препаратов, содержащих определенный комплекс ферментов, в других — требуются препараты индивидуальных ферментов.
В соответствии со спецификой плодово-ягодного сырья и целями применения ферментные препараты можно разделить на шесть групп:
1. Ферменты, предназначенные для получения неосветленных соков, увеличивающие выход и повышающие экстрактивность — Пектиназа.
2. Ферменты, предназначенные для получения осветленных соков, увеличивающие выход, повышающие экстрактивность и обеспечивающие полный гидролиз пектиновых и белковых веществ — Пектиназа, Пектинлиаза, Протеаза кислая.
3. Ферменты, мацерирующие плодово-ягодную ткань, повышающие выход и гомогенность соков с мякотью — Пектинлиаза.
4. Ферменты, предназначенные для получения осветленных плодово-ягодных виноматериалов, увеличивающие выход и повышающие экстрактивность виноматериалов — Пектиназа, Глюкоамилаза.
5. Ферменты, способствующие предотвращению окислительных процессов и развитию аэробных микроорганизмов в соках, винах, безалкогольных напитках — Глюкозооксидаза.
6. Ферменты, катализирующие инверсию сахарных сиропов при производстве безалкогольных напитков и товарных сиропов — Инвертаза.
Производство спиртных напитков
Крахмал, как основной компонент сухих веществ зернового сырья, из которого и образуется спирт, непосредственно дрожжами не сбраживается. Поэтому его необходимо гидролизовать до сбраживаемых сахаров, для этого требуется применение ферментов, которые осуществляют гидролиз крахмала до сбраживаемых сахаров, являются источником азотистого питания для дрожжей и при осахаривании крахмалистого сырья производят частичное разрушение клеточных стенок сырья.
Применяемый издавна зерновой солод, как источник амилолитических ферментов, обеспечивает достаточно глубокое осахаривание и выбраживание, однако скорость осахаривания крахмала при использовании солода остается достаточно низкой, что затрудняет интенсификацию процесса брожения. Применение ферментных препаратов микробного происхождения (Альфа-амилаза, Глюкоамилаза) дает возможность значительно повысить концентрацию необходимых ферментов в среде и обеспечить глубокий гидролиз крахмала за сравнительно короткий период.
Кроме стадии осахаривания ферментные препараты, обладающие сильной разжижающей активностью (Альфа-амилаза), применяются на стадии водно-тепловой обработки сырья с целью смягчить режим разваривания, снизить вязкость замесов и облегчить их дальнейшую транспортировку. Применяя ферментные препараты на стадии приготовления сусла для дрожжегенерации, необходимо обеспечить интенсивный гидролиз белков с целью обогащения ценным азотистым питанием дрожжевого сусла.
Таким образом, для спиртового производства, перерабатывающего крахмалсодержащее сырье, необходимо применение ферментных пре паратов с амилолитическим, протеолитическим и цитолитическим действием.
Пивоварение
При производстве пива по обычной технологической схеме, необходимые ферменты (для подготовки зернового сырья и перевода экстрактивных веществ в растворимое состояние на стадии затирания) образуются в процессе солодоращения.
Основными ферментами, образующимися в процессе солодоращения и имеющими наиболее существенное значение в технологии пивоварения, являются:
1. Амилолитические ферменты, разжижающие и осахаривающие крахмал (Альфа-амилаза бактериальная, Амилоризин, Глюкоамилаза).
2. Протеолитические ферменты, расщепляющие белки ячменя до пептидов различной молекулярной массы и свободных аминокислот (Протеаза).
3. Цитолитические ферменты, гидролизующие некрахмальные полисахариды, растворяющие клеточные стенки эндосперма зерна, благодаря чему облегчается доступ амилаз и протеаз к соответствующим субстратам (Целлюлаза).
Каждый из перечисленных процессов должен пройти с определенной глубиной, чтобы обеспечить нормальное протекание фильтрации затора, брожения сусла, осветление и фильтрацию пива, а также создание определенных физико-химических свойств (ценообразование, прозрачность, стойкость при хранении) и вкусовых качеств готового продукта.
Применение ферментных препаратов микробного происхождения (амилоризин, амилосубтилин, проторизин) с целью замены солода несоложенным ячменем позволяет интенсифицировать процесс, избежать потерь ценных компонентов сырья на дыхание и образование проростка, в целом повысить рентабельность пивоваренного производства.
Переработка мяса и рыбы
В последнее время ферментные препараты все шире используются в переработке мяса и рыбы. Это связано с их способностью продуцировать в тканях мяса и рыбы специфические биологически активные компоненты: органические кислоты, бактериоцины, ферменты, витамины, что способствует улучшению санитарно- микробиологических, органолептических показателей готового продукта, а также позволяет интенсифицировать производственный процесс.
Ферментативные методы позволяют повысить качество мяса, удовлетворить растущие требования потребителей и увеличить степень переработки сырья. Известны два основных направления использования ферментов в мясной промышленности: тендеризация жесткого мяса и реструктурирование свежего низкокачественного мясного сырья и обрези (тримминга) с получением продукта высокого качества.
В мясной индустрии и кулинарии используют в основном ферменты, разлагающие белки (Протеаза, Коллагеназа), а так же ферменты «сшивающие» белки (Трансглутаминаза) в качестве улучшителей текстуры. В последнее время становятся популярными новые направления использования традиционных ферментов в молекулярной кухне. Примерами могут служить окисляющие ферменты для получения продукции с заданной структурой и получение требуемого вкуса и аромата с помощью липаз, глутаминаз, протеаз и пептидаз.
Ферменты и их функции
directions
В организме постоянно происходит ряд химических превращений веществ, поступающих извне. Эти реакции могут происходить только в присутствии определённых катализаторов. Последние в свою очередь представлены в виде веществ белковой природы – ферментов. Они ускоряют процесс обмена веществ, способствуют достижению равновесия. Благодаря воздействию ферментов реакции, происходящие в организме, ускоряются в сотни раз. Изменение концентрации этих веществ в организме указывает на развитие очень опасных заболеваний. При этом активность ферментов снижается намного раньше, чем появляются более явные признаки болезни. Данный вид анализа позволяет точно диагностировать наличие того или иного заболевания и своевременно приступить к лечению. В нашей лаборатории Вы сможете пройти все необходимые исследования.
Эти реакции могут происходить только в присутствии определённых катализаторов. Последние в свою очередь представлены в виде веществ белковой природы – ферментов. Они ускоряют процесс обмена веществ, способствуют достижению равновесия. Благодаря воздействию ферментов реакции, происходящие в организме, ускоряются в сотни раз. Изменение концентрации этих веществ в организме указывает на развитие очень опасных заболеваний. При этом активность ферментов снижается намного раньше, чем появляются более явные признаки болезни. Данный вид анализа позволяет точно диагностировать наличие того или иного заболевания и своевременно приступить к лечению. В нашей лаборатории Вы сможете пройти все необходимые исследования.
Врачи-специалисты
Старшая медицинская сестра
Медицинская сестра
Медицинская сестра эндоскопического кабинета
Врач-терапевт
Медицинская сестра процедурной
Анализ на коронавирус методом ПЦР. Результат в течение 3-х дней
Результат в течение 3-х дней
Наши клиники в Санкт-Петербурге
Медицентр Юго-ЗападПр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону +7 (812) 640-55-25
Свойства ферментов:
- В первую очередь, как уже было сказано выше, ферменты непосредственно влияют на скорость химических реакций, происходящих внутри организма.

- Специфичность действия. Так как в организме постоянно протекает огромное количество реакций, для ускорения каждой из них вырабатывается свой особый фермент, который не может действовать на другие процессы. В связи со специфичностью действия различают две группы ферментов:
- относительную — фермент катализирует определённый вид реакций;
- абсолютную — когда фермент отвечает за ход только одной реакции.
- Активность ферментов характеризует их способность в различной степени ускорять происходящие в организме реакции. Этот показатель зависит от следующих факторов: температуры, рН среды т. д.
Виды анализов на ферменты
Аланинаминотрансфераза (АЛТ) является ферментом печени и принимает участие в обмене аминокислот. При разрушении клеток почек, печени, скелетной мускулатуры и сердечной мышцы происходит увеличение концентрации АЛТ в крови. Результаты анализа могут указывать на следующие заболевания:
- вирусный гепатит А и другие виды гепатита;
- цирроз или рак печени;
- поражение печени токсинами;
- хронический алкоголизм;
- панкреатит;
- желтуха;
- инфаркт миокарда;
- ожоги.

Амилаза вырабатывается в поджелудочной и слюнных железах. Обеспечивает расщепление углеводов, поступающих в организм вместе с пищей. Повышенное содержание альфа-амилазы является симптомом следующих заболеваний: киста, перитонит, панкреатит, паротит, сахарный диабет, почечная недостаточность. Так же увеличение альфа-амилазы происходит при прерывании беременности или травме живота. Панкреатическая амилаза синтезируется в поджелудочной железе. Её уровень возрастает при травмах поджелудочной железы, острых панкреатитах, почечной недостаточности, алкоголизме, язве.
Аспартатаминотрансфераза (АСТ) — фермент, который содержится в нервной, скелетной тканях, а так же в клетках сердца, почек, печени и других органов. Результаты анализа могут давать как повышенные значения (при раке печени, гепатите, сердечной недостаточности, стенокардии), так показывать и низкий уровень вследствие разрыва печени и тяжёлых заболеваний.
Креатинкиназа входит в состав клеток головного мозга, лёгких, щитовидной железы, скелетной мускулатуры, сердечной мышцы. Повышение креатинкиназы отмечается, когда происходит нарушение в работе любого из перечисленных органов. Наиболее часто увеличение активности наблюдается при остром инфаркте миокарда, заболеваниях скелетных мышц, головного мозга, гипотериозе.
Повышение креатинкиназы отмечается, когда происходит нарушение в работе любого из перечисленных органов. Наиболее часто увеличение активности наблюдается при остром инфаркте миокарда, заболеваниях скелетных мышц, головного мозга, гипотериозе.
Липаза синтезируется органами для расщепления жиров. Анализ проводится для выявления и диагностики заболеваний. Повышенное содержание липазы в крови говорит о наличии следующих заболеваний:
- опухоли;
- панкреатит;
- болезни желчного пузыря;
- рак молочной железы;
- почечная недостаточность;
- ожирение;
- подагра.
Понижение уровня встречается в случае возникновения онкологических заболеваний.
Холинэстераза образуется в печени. Анализ на холинэстеразу проводится для оценки функции печени либо при отравлении инсектицидами. Содержание фермента резко снижается при тяжёлых заболеваниях печени, инфаркте миокарда, циррозе, онкологических заболеваниях, гепатите (например, при гепатите В). Понижение уровня этого фермента характерно на последнем сроке беременности, в то время как на начальном этапе отмечается его увеличение. Повышение холинэстеразы является симптомом следующих заболеваний: ожирение, рак молочной железы, столбняк, сахарный диабет, алкоголизм, маниакально-депрессивный психоз, неврозы.
Понижение уровня этого фермента характерно на последнем сроке беременности, в то время как на начальном этапе отмечается его увеличение. Повышение холинэстеразы является симптомом следующих заболеваний: ожирение, рак молочной железы, столбняк, сахарный диабет, алкоголизм, маниакально-депрессивный психоз, неврозы.
Щелочная фосфатаза принимает участие в обмене фосфорной кислоты. Проводят анализ для диагностики заболеваний печени, костной системы. Повышение щелочной фосфатазы встречается при миеломной болезни, рахите, инфекционном мононуклеозе, поражениях костей, заболеваниях печени, снижение – признак недостатка витаминов, магния, цинка, анемии. При мониторинге беременности так же проводится анализ на щелочную фосфатазу. Снижение её активности происходит в случае недостаточного развития плаценты.
1285,1299,1262,871,757,746
Иванова Ольга Сергеевна 18. 12.2020
23:15
12.2020
23:15 medi-center.ru
Огромная благодарность Шаговой Любови Сергеевне! Три недели не могла решить свою проблему со здоровьем, но тут, по совету знакомой, записалась к Любовь Сергеевне, и это любовь с первого взгляда! И все лечение очень помогло, и сама врач очень помогла. Очень приветливая и вежливая доктор!
Кириличев Кирилл Александрович 03.12.2020 10:44medi-center.ru
Хочу поблагодарить терапевта Дерешовского Александра Сергеевича, за профессионализм и внимательность к пациенту. Именно этими качествами должен обладать настоящий Врач.
Доктор всегда был на связи, проявлял интерес к самочувствию и готов был ответить на любой поставленный мной вопрос. Побольше бы таких специалистов в такое непростое для всех время.
Побольше бы таких специалистов в такое непростое для всех время.
medi-center.ru
Сердечно благодарим доктора Попову К.Е. за высокий профессионализм, внимательность и отзывчивость при домашнем визите и рекомендациях по лечению. Спасибо Вам большое!
Добры день всем, хочу выразить благодарность врачу-неврологу Братановой Ирине Валерьевне. На прием пришел с параличом лицевого нерва, левая сторона лица была практически парализована. Как оказалось, иглорефлексотерапия вполне успешно лечит такие болезни, спустя пару сеансов были заметны изменения в лучшую сторону, а на 8-9-м все пришло в норму, считаю это не только своей заслугой, но и врача :). Цены на ИРТ по району кстати довольно умеренные, а клиника на ул. Поликарпова 6 произвела хорошее впечатление.
Поликарпова 6 произвела хорошее впечатление.
Добрый вечер, хочу выразить благодарность клинике на Охтинской аллее, прикрепились с мужем по ОМС, всегда чисто, приятный персонал, приветливый, внимательный, всегда подскажет и ответит на любой вопрос, врачи специалисты в своем деле, принимают в назначенное время, без очередей.
Здравствуйте! Была в Медицентре на Охтинской аллее 16, в Мурино, прикрепилась по ОМС, потрясающе приятная девушка терапевт Валерия Дмитриевна, прописала лечение, быстро поставила меня на ноги, выписали больничный, все как надо очень быстро без всяких очередей, очень удобно и рядом с домом! Очень вежливый персонал, все очень понравилось! Спасибо!
какова их роль и что делать при нехватке ферментов для пищеварения?
Процесс пищеварения чрезвычайно сложен, он происходит в несколько этапов в разных органах человеческого организма. Но на каждом этапе в нем принимают участие ферменты — вещества, с помощью которых сложные компоненты пищи расщепляются на более простые, без труда усваиваемые организмом. Без ферментов пищеварение было бы невозможным, так что не стоит недооценивать их роль в обеспечении хорошего самочувствия и поддержании здоровья человека.
Без ферментов пищеварение было бы невозможным, так что не стоит недооценивать их роль в обеспечении хорошего самочувствия и поддержании здоровья человека.
Пищеварительные ферменты — главные участники процесса пищеварения
Переваривание пищи начинается и заканчивается не в желудке, как ошибочно полагают многие. Первый этап процесса происходит непосредственно в ротовой полости, где пища измельчается механически и подвергается воздействию альфа-амилазы — фермента слюнных желез, который превращает молекулы крахмала в растворимые сахара. Кстати, именно поэтому так важно качественно пережевывать пищу, ведь чем дольше она находится во рту, тем лучше обрабатывается ферментами и измельчается. А значит, на последующих этапах организму будет значительно легче обрабатывать пищевой комок.
На втором этапе, в желудке к пищеварительному процессу подключаются желудочные ферменты. Любой квадратный миллиметр слизистой этого органа содержит около сотни так называемых желудочных ямок, в каждой из которых имеется три–семь просветов особых желез, производящих необходимые ферменты и соляную кислоту. Именно благодаря им производится известный всем желудочный сок. Основной желудочный фермент — это пепсин, разлагающий белки на пептиды. Он производится клетками в неактивной форме, чтобы не допустить самопереваривания клеток желудка. В активную форму ему помогает перейти соляная кислота, которая к тому же отвечает за уничтожение всех попадающих в организм вредных бактерий.
Именно благодаря им производится известный всем желудочный сок. Основной желудочный фермент — это пепсин, разлагающий белки на пептиды. Он производится клетками в неактивной форме, чтобы не допустить самопереваривания клеток желудка. В активную форму ему помогает перейти соляная кислота, которая к тому же отвечает за уничтожение всех попадающих в организм вредных бактерий.
Кроме пепсина в желудке также вырабатывается желатиназа, расщепляющая коллаген и желатин, содержащиеся в мясе.
Третий этап. Из желудка пища направляется в тонкий кишечник, в котором происходит главный процесс переваривания. Именно здесь организм вырабатывает целый комплекс различных ферментов, каждый из которых отвечает за свою сферу деятельности. Главный производитель ферментов — поджелудочная железа, за сутки ей под силу произвести до двух литров панкреатического сока, способного расщеплять все питательные вещества. В его состав входят несколько групп ферментов:
- Протеазы (трипсин и химотрипсин) — расщепляют белки, содержащиеся в пище, до аминокислот.

- Карбоксипептидаза и эластазы — расщепляют эластин.
- Нуклеазы — расщепляют нуклеиновые кислоты ДНК.
- Амилаза — воздействует на гликоген, крахмал и прочие углеводы, расщепляя их до ди- и моносахаридов.
- Липаза — очень важный фермент, расщепляющий жиры до жирных кислот и моноглицеридов.
Активация и последующая работа всех панкреатических ферментов происходит в начальном отделе тонкого кишечника — в просвете двенадцатиперстной кишки.
Четвертый этап. Пищеварение в тонком кишечнике на этом не заканчивается — далее пища подвергается воздействию примерно 20 ферментов тонкой кишки, содержащихся в кишечном соке. Этот сок содержит в своем составе несколько пептидаз, включая энтеропетидазу, превращающую трипсиноген в активный трипсин, сахаразу, мальтазу и изомальтазу, лактазу, липазу и эрепсин. Ферменты кишечного сока завершают пищеварительный процесс, полностью расщепляя все питательные вещества и обеспечивая их всасывание организмом.
Причины недостатка пищеварительных ферментов
При нормальном функционировании всех систем, ответственных за пищеварение и продуцирование ферментов, организм человека находится в сбалансированном состоянии — пища благополучно переваривается, отдавая ему нужные питательные элементы. Но иногда выработка ферментов нарушается, что влечет за собой определенные клинические последствия.
Экзокринная недостаточность — снижение пищеварительной функции поджелудочной железы — может наблюдаться при многих болезнях желудочно-кишечного тракта. Она бывает абсолютной и относительной.
Абсолютная недостаточность обусловлена уменьшением объема функционирования поджелудочной железы при:
- хроническом панкреатите, камнях поджелудочной железы;
- субтотальной панкреатэктомии;
- свищах поджелудочной железы;
- раке поджелудочной железы;
- муковисцидозе;
- квашиоркоре (белковом голодании).
Относительная панкреатическая недостаточность может развиваться в результате:
- снижения активности энтерокиназы, инактивации панкреатических ферментов в кишечнике и снижения концентрации ферментов в результате разведения при:
- постгастроэктомическом синдроме;
- состоянии после холецистэктомии;
- дисбиозе в тонкой кишке;
- синдроме Золлингера-Эллисона;
- язвенной болезни двенадцатиперстной кишки;
- дуодените;
- нарушения транзита кишечного содержимого и нарушения смешивания ферментов с пищевым химусом при:
- дуодено- и гастростазе;
- интестинальной псевдообструкции;
- синдроме раздраженного кишечника;
- состояниях после ваготомии и дренирующих операциях;
- нарушения продукции холецистокинина, панкреозимина, секретина — дефицита желчных кислот в тонкой кишке, врожденного или при:
- билиарной обструкции;
- тяжелых гепатитах;
- первичном билиарном циррозе;
- патологии терминального отдела тонкой кишки;
- дисбиозе тонкой кишки;
- лечении холестирамином;
- гастрогенной недостаточности при:
- резекции желудка, гастрэктомии;
- атрофическом гастрите.

Симптомы ферментной недостаточности при болезнях поджелудочной железы обычно выражены весьма ярко. Это тошнота, диарея, полифекалия, метеоризм. Одним из характерных признаков является наличие в кале плохо переваренных комочков пищи, которые появляются именно из-за недостатка панкреатических ферментов. Из-за слабого усвоения питательных веществ у больного возникает анемия, авитаминоз и истощение организма.
В любом случае ферментная недостаточность является весьма неприятной, а иногда и опасной патологией, которую необходимо лечить.
Что можно сделать для улучшения пищеварения
Одним из главных направлений в лечении пациентов с ферментной недостаточностью можно считать заместительную ферментную терапию.
Это интересно
Впервые заместительную ферментную терапию 150 лет назад применил врач из Нидерландов Д. Флеш. Он использовал для лечения стеатореи — повышенного количества жира в каловых массах у больного с сахарным диабетом — экстракт поджелудочной железы теленка[1].
Показания для ферментной терапии можно разделить на несколько групп, в которые входят заболевания поджелудочной железы, болезни тонкой и толстой кишки, патологии желудка, диспепсия, болезни желчных путей и печени, нарушения моторики ЖКТ, переедание. Подбор ферментных препаратов для разных групп несколько отличается, но при этом все они должны иметь хорошую переносимость пациентом, минимум побочных действий, устойчивость к агрессивному влиянию желудочного сока и длительный срок хранения.
На сегодня выделены следующие группы ферментных препаратов:
- Экстракты слизистой желудка, в качестве главного действующего вещества которых выступает пепсин (например, Абомин®, «Ацидин-пепсин»). Эта группа направлена главным образом на коррекцию гастрогенной ферментной недостаточности.
- Препараты с панкреатином, в состав которого входят протеазы, амилаза и липаза (Микразим®). Они применяются для терапии панкреатической ферментной недостаточности.
 Такие препараты отлично помогают поджелудочной железе переваривать любую пищу, поддерживая нужный уровень ферментов и обеспечивают органу покой, поскольку высокая концентрация ферментов в просвете двенадцатиперстной кишки снижает активность поджелудочной.
Такие препараты отлично помогают поджелудочной железе переваривать любую пищу, поддерживая нужный уровень ферментов и обеспечивают органу покой, поскольку высокая концентрация ферментов в просвете двенадцатиперстной кишки снижает активность поджелудочной. - Растительные энзимы, представленные папаином, грибковой амилазой, протеазой, липазой и другими ферментами (Пепфиз®).
- Комбинированные препараты на основе панкреатина, гемицеллюлазы и компонентов желчи (к примеру, Ферестал®). Они показаны для стимулирования работы поджелудочной железы, моторики кишечника и желчного пузыря.
- Комбинированные ферменты, содержащие панкреатин в сочетании с растительными энзимами, витаминами («Вобэнзим»).
- Дисахаридазы (например, «Тилактаза»).
Ферментная терапия в первую очередь должна быть направлена на поддержку способности организма переваривать пищу. Хотя она и не может окончательно восстановить функции больных органов, но зато вполне способна взять на себя большую часть их работы. С помощью ферментной терапии организм человека может полноценно получать питательные вещества из потребляемой пищи в течение многих лет.
Хотя она и не может окончательно восстановить функции больных органов, но зато вполне способна взять на себя большую часть их работы. С помощью ферментной терапии организм человека может полноценно получать питательные вещества из потребляемой пищи в течение многих лет.
Рекомендуется ферментная терапия и в тех случаях, когда был нарушен режим питания. Нередко неприятные симптомы (диспепсия, метеоризм, диарея) после злоупотреблений чересчур жирной или острой пищей могут свидетельствовать о ферментной недостаточности. Грамотно назначенный ферментный препарат способен быстро и практически бесследно устранить все последствия пищевых нарушений.
Следует помнить, что хотя ферментная терапия может быть показана, все же приступать к приему лекарств нужно только после консультации с лечащим врачом. Дело в том, что при некоторых формах заболеваний, например при остром панкреатите, ферментная терапия противопоказана до окончания острого периода заболевания. К тому же врач назначит препарат, исходя именно из индивидуальных особенностей организма пациента, течения основного заболевания и состояния здоровья на данный момент.
Перенос групп ферментов — Справочник химика 21
Изомеразы. К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров. Систематическое название их составляют с учетом типа реакции субстрат—гвнутримолекулярный перенос группы, фермент получает название мутаза . [c.161]Трансферазы — ферменты, катализирующие реакции переноса групп. [c.5]
СООН, N1 2, ЫН, ОН, 5Н, а также гидрофобные группы, способные ориентировать молекулы реагирующих веществ в определенном положении по отношению к активному центру. В состав активного центра многих ферментов входят ионы металлов, причем при удалении иона металла из металлофермента последний теряет каталитические свойства. Каталитическая активность ферментов имеет максимум на шкале pH, в сильнокислых и сильнощелочных средах она, как правило, не проявляется. Каталитическая активность ферментов наиболее оптимальна при температуре от 20 до 40° С, при 60 — 70° С происходит их денатурация. Активные центры имеют строго определенную структуру, что позволяет ферменту присоединять только молекулы определенного строения. Так, например, фермент уреаза гидролизует карбамид СО(Nh3) в 10 раз быстрее, чем ион водорода, и не оказывает влияния на реакции гидролиза других родственных карбамиду соединений. В настоящее время известно около тысячи ( )ер-ментов, одни из которых катализируют только окислительно-восстановительные процессы, другие—реакции с переносом групп, третьи—реакции гидролиза и т. д. [c.184]
Активные центры имеют строго определенную структуру, что позволяет ферменту присоединять только молекулы определенного строения. Так, например, фермент уреаза гидролизует карбамид СО(Nh3) в 10 раз быстрее, чем ион водорода, и не оказывает влияния на реакции гидролиза других родственных карбамиду соединений. В настоящее время известно около тысячи ( )ер-ментов, одни из которых катализируют только окислительно-восстановительные процессы, другие—реакции с переносом групп, третьи—реакции гидролиза и т. д. [c.184]
Гидролазы — ферменты, катализирующие перенос групп на молекулу, воды. [c.75]
Прямой перенос протона между атомами С-1 и С-2 при действии изо-мераз сахаров может показаться удивительным. Как может очень подвижный протон оставаться присоединенным к группе фермента в течение миллисекунд или более, а не переноситься к молекулам растворителя Может ли это означать, что в присутствии фермента предпочтительно происходит перенос гидрид-иона или атома водорода, а не перенос протона Если это так, то наблюдаемый обмен протона с [c. 155]
155]
Ферменты часто катализируют перенос групп атомов с субстрата на продукт. Функция кофермента при этом заключается в приеме группы с субстрата, обычно путем образования кова- [c.602]
Трансферазы. Представители этой группы ферментов катализируют перенос различных групп оГ одной молекулы к другой, например фосфорилирование, переаминирование. Эти ферменты принимают участие в сложных биохимических процессах, протекающих в клетках. [c.23]
Важными аспектами реакционной способности органических соединений являются их кислотные и основные свойства. Эти свойства часто обусловливают существование большинства органических биомолекул в условиях организма в ионном состоянии. Перенос протона, например между атомами кислорода, азота и серы, наблюдается в ходе многих биохимических реакций. Большую роль в биохимических процессах также играет кислотный или основный катализ, осуществляемый с участием соответствующих ионогенных групп ферментов. [c.100]
[c.100]
Трансферазы. Ферменты этого класса осуществляют перенос групп атомов. Их названия включают в себя такие понятия, как донор акцептор — транспортируемая группа — трансфераза . Эти ферменты разделены на подклассы, катализирующие перенос углеродных остатков. Рассмотрим несколько примеров. [c.66]
Аминотрансферазы — группа ферментов, катализирующих перенос аминогруппы от одного метаболита к другому их называют также трансаминазами. [c.23]
Изомеразы — катализируют реакции изомеризации, например превращение альдегидов в кетоны, цис-формы в трансформу и наоборот. Если изомеризация заключается во внутримолекулярном переносе группы, фермент называют мутазой. Если происходит инверсия асимметрических групп, фермент называют рацемазой или эпимеразой, например [c.101]
Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют мутазой например, фермент фосфо-глюкомутаза катализирует реакцию обратимого превращения глюкопирапозо-1-фосфорной кислоты в глюкопиранозо-б-фосфор-ную кислоту [c.
 154]
154] В активный каталитический центр входят группы, которые могут ориентировать молекулы субстрата в определенном положении по отношению к активному центру. Активный центр фермента имеет строго определенную структуру. Он подобен матрице, в которую может войти молекула только определенного строения. Обычно в ферменте на участок цепи с молекулярной массой 30 000—80 ООО приходится один активный центр. В настоящее время известно около тысячи ферментов. Отдельные группы ферментов катализируют окислительно-восстановительные реакции (оксидоредуктазы) реакции с переносом групп (трансферазы) реакции гидролиза (гидролазы) реакции отщепления групп атомов негидролитическим путем с образованием двойной связи или присоединением по двойной связи (лиазы) реакции изомеризации (изомеразы) реакции присоединения двух молекул (синтетазы). Приведенный перечень реакций, катализируемых ферментами, показывает, что при температурах 0—40° С в живом организме синтезируются высокоэффективные катализаторы практически для всех реакций, связанных с жизнедеятельностью организма. [c.632]
[c.632]
В природе распространены системы, в которых небелковый кофер-мент обеспечивает протекание реакции переноса группы (ацильной, оксиметильной, формильной, метильной и др.) один из ферментов переносит группу от первого субстрата к коферменту, а другой — от кофермента ко второму субстрату. Наибольшее биологическое значение имеют, по-видимому, реакции трансфосфорилирования, которые обеспечивают передачу энергии от одного процесса к другому. Переносчиками фосфатной группы служат различные нуклеотиды и нуклеози ды, например аденозиндифосфат (АДФ) [c.16]
Трансферазы — ферменты, способствующие переносу различных химических групп с одной молекулы на другую. Например, трансамипаза ускоряет перенос группы —N1 2 траисметплаза —СНз трапскстолаза —С = 0 (кетогруппу). [c.259]
Цитохромоксидаза представляет собой сложный белковый комплекс, в состав которого входит по меньшей мере 8 индивидуальных полипептидов. Во внутримолекулярном переносе электронов участвуют простетические группы фермента гемы а и з, а также 2 атома меди ua и ub. Трансмембранный перенос электронов от цитохрома с к молекулярному кислороду сопровождается векторным переносом протона из матрикса митохондрий в межмембранное пространство. Разность электрохимических потенциалов ионов водорода, генерируемая в цитохромоксидазной реакции на мембране митохондрий, может быть использована для синтеза АТФ. [c.432]
Трансмембранный перенос электронов от цитохрома с к молекулярному кислороду сопровождается векторным переносом протона из матрикса митохондрий в межмембранное пространство. Разность электрохимических потенциалов ионов водорода, генерируемая в цитохромоксидазной реакции на мембране митохондрий, может быть использована для синтеза АТФ. [c.432]
ГЛИКОЗИЛТРАНСФЕРАЗЫ, группа ферментов класса трансфераз, катализирующих перенос гликозильных групп на орто- и пирофосфорную к-ты, олиго- и полисахариды, Н2О или др. акцептор. Делятся на гексозил- и пентозил-трансферазы. Обладают строгой субстратной специфичностью по отношению к донору углевода и к конфигурации синтезируемой связи. [c.578]
И заме. разы. Ферменты, отнесенные к этому классу, катализируют разнообразные реакции изомеризации, например превращение циеформы в трансформу, взаимопревращение альдоз и кетоз, внутримолекулярный перенос групп (в последнем случае ферменты называют му-тазами) и т. д. [c.113]
д. [c.113]
Большинство из перечисленных металлов, за исключением непереходных цинка, кадмия, ртути и свинца, относятся к й-эле-ментам. Наличие вакансий в электронных оболочках -элементов обуславливает легкость их включения в комплексные соединения, в том числе и с биолигандами. Благодаря этому такие металлы с переменной валентностью, как Си, Со, N1, V, Сг, Мп, Ке, наряду с цинком и молибденом входят в состав простетических групп ферментов и некоторых белков. В составе комплексов с биомолекулами они участвуют в переносе кислорода, алкильных групп и во многих других жизненно важных процессах и реакциях. Однако индивидуальная потребность организмов в тяжелых металлах очень мала, а поступление из внешней среды избыточных количеств этих элементов приводит к различного рода токсическим эффектам. [c.244]
Гексокиназа, подобно большинству ферментов, катализирующих перенос фосфатных групп, проявляет абсолютную потребность в двухвалентном катионе, в роли которого добычно выступает ион Mg +.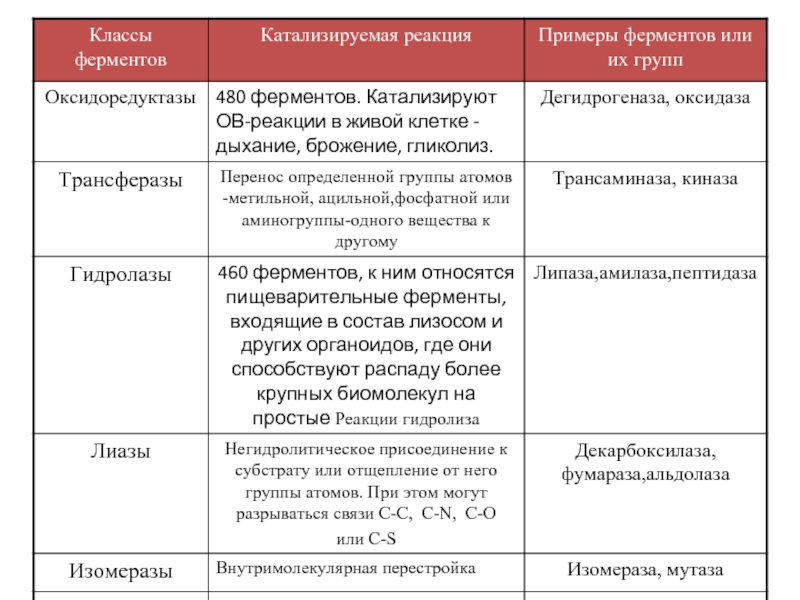 Хотя Истинным субстратом гексокиназы считается комплекс АТР с Mg +, точный механизм комплексообразования металла с полифосфатом на поверхности фермента не известен. По-видимому, металл связывается и с группами фермента, и с группами субстрата. [c.125]
Хотя Истинным субстратом гексокиназы считается комплекс АТР с Mg +, точный механизм комплексообразования металла с полифосфатом на поверхности фермента не известен. По-видимому, металл связывается и с группами фермента, и с группами субстрата. [c.125]
Биохимические процессы в клетке контролируются специальными белками -ферментами. Ферменты являются биокатализаторами с очень высокой эффективностью и специфичностью. Они могут увеличивать скорость реакций в 10 и более раз. Очень часто ферменты называют по субстрату с окончанием аза . Так, фермент цел-люлаза катализирует гидролиз целлюлозы. Используются также названия ферментов по катализируемой реакции. Например, гидролазы катализируют гидролиз, дегидрогеназы — отрыв водорода и т.д. В связи с увеличением числа известных ферментов в настоящее время по катализируемым реакциям все ферменты разделены на шесть классов оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и лигазы. Ок-сидоредуктазы катализируют обратимые окислительно-восстановительные реакции, в которых происходит перенос водорода, электронов или гидрид-нонов.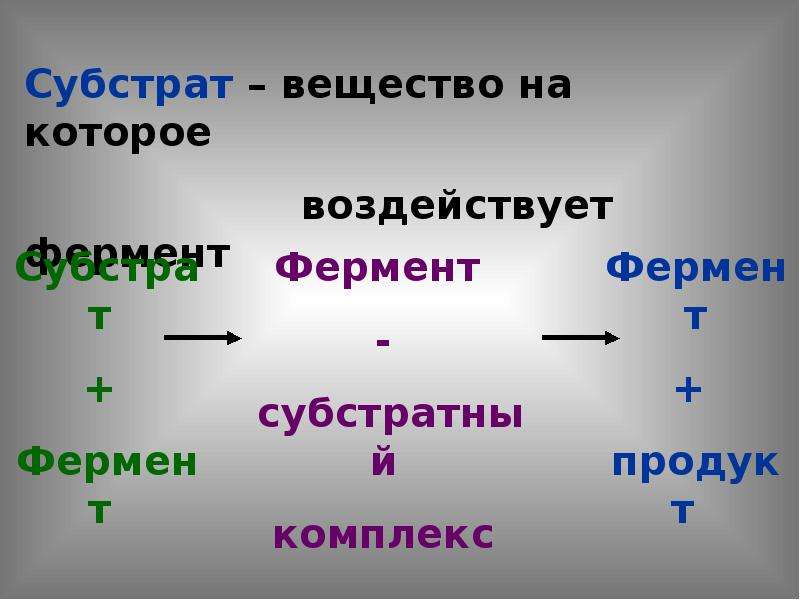 Трансферазы переносят группы атомов от одного соединения к другому. Гидролазы катализируют гидролитическое расщепление различных связей (гликозидных, пептидных, эфирных и др.). Лиазы катализируют реакции, в которых происходит расщепление химических связей с образованием двойных связей илн присоединение по двойным связям. Изомеразы воздействуют на процессы изомеризации. Л и газы (син-тетазы) катализируют образование связи между двумя соединениями, используя энергию АТФ и других высокоэнергетических соединений. [c.327]
Трансферазы переносят группы атомов от одного соединения к другому. Гидролазы катализируют гидролитическое расщепление различных связей (гликозидных, пептидных, эфирных и др.). Лиазы катализируют реакции, в которых происходит расщепление химических связей с образованием двойных связей илн присоединение по двойным связям. Изомеразы воздействуют на процессы изомеризации. Л и газы (син-тетазы) катализируют образование связи между двумя соединениями, используя энергию АТФ и других высокоэнергетических соединений. [c.327]
Во мно1 их случаях кофермент можно отделить от белка-фермента. Таким образом, коферменты можно иногда рассматривать в качестве особой формы косубстрата ферментативной реакции. Коферменты обычно функционируют в качестве акцепторов или доноров функциональных групп или атомов и часто связывают два фермента друг с другом с образованием ферментной системы [1]. В этом случае один фермент переносит группу или атом с субстрата на кофермент, а второй — с кофермента на второй субстрат. В настоящее время в большинстве случаев возможно объяснение процесса переноса в терминах механизмов органических реакций. [c.580]
В настоящее время в большинстве случаев возможно объяснение процесса переноса в терминах механизмов органических реакций. [c.580]
Ферментативный перенос протона с участием атомов азота мы рассмотрим на примере ацетоацетатдекарбоксилазы, входя-щей в многочисленную группу ферментов, механизм действия которых включает образование в качестве промежуточного соединения основания Шиффа (имина). Ацетоацетатдекарбоксила- [c.146]
Особую группу ферментов составляют надмолекулярные (или мультимолекулярные) ферментные комплексы, в состав которых входят не субъединицы (в каталитическом отношении однотипные протомеры), а разные ферменты, катализирующие последовательные ступени превращения какого-либо субстрата. Отличительными особенностями подобных муль-тиферментных комплексов являются прочность ассоциации ферментов и определенная последовательность прохождения промежуточных стадий во времени, обусловленная порядком расположения каталитически активных (различных) белков в пространстве ( путь превращения в пространстве и времени). Типичными примерами подобных мультиферментных комплексов являются пируватдегидрогеназа и а-кетоглутаратдегидрогеназа, катализирующие соответственно окислительное декарбоксилирование пировиноградной и а-кетоглутаровой кислот в животных тканях (см. главу 10), и синтетаза высших жирных кислот (см. главу 11). Молекулярные массы этих комплексов в зависимости от источника их происхождения варьируют от 2,3 10 до 10 10 Ассоциация отдельных ферментов в единый недиссоциирующий комплекс имеет определенный биологический смысл и ряд преимуществ. В частности, при этом резко сокращаются расстояния, на которые молекулы промежуточных продуктов должны перемещаться при действии изолированных ферментов. Ряд таких мультиферментных комплексов, иногда называемых ферментными ансамблями, структурно связан с какой-либо органеллой (рибосомы, митохондрии) или с биомембраной и составляет высокоорганизованные надмолекулярные системы, обеспечивающие жизненно важные функции, например тканевое дыхание (перенос электронов от субстратов к кислороду через систему дыхательных ферментов).
Типичными примерами подобных мультиферментных комплексов являются пируватдегидрогеназа и а-кетоглутаратдегидрогеназа, катализирующие соответственно окислительное декарбоксилирование пировиноградной и а-кетоглутаровой кислот в животных тканях (см. главу 10), и синтетаза высших жирных кислот (см. главу 11). Молекулярные массы этих комплексов в зависимости от источника их происхождения варьируют от 2,3 10 до 10 10 Ассоциация отдельных ферментов в единый недиссоциирующий комплекс имеет определенный биологический смысл и ряд преимуществ. В частности, при этом резко сокращаются расстояния, на которые молекулы промежуточных продуктов должны перемещаться при действии изолированных ферментов. Ряд таких мультиферментных комплексов, иногда называемых ферментными ансамблями, структурно связан с какой-либо органеллой (рибосомы, митохондрии) или с биомембраной и составляет высокоорганизованные надмолекулярные системы, обеспечивающие жизненно важные функции, например тканевое дыхание (перенос электронов от субстратов к кислороду через систему дыхательных ферментов).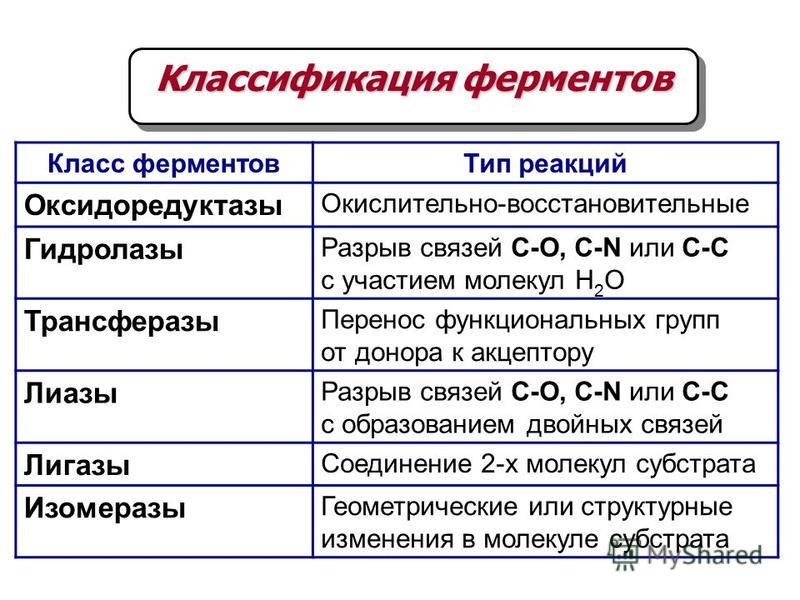 [c.129]
[c.129]
Биологическая роль. Рибофлавин входит в состав флавиновых коферментов, в частности ФМН и ФАД , являющихся в свою очередь простетическими группами ферментов ряда других сложных белков —флавопротеинов. Некоторые флавопротеины в дополнение к ФМН или ФАД содержат еще прочно связанные неорганические ионы, в частности железо или молибден, наделенные способностью катализировать транспорт электронов. Различают 2 типа химических реакций, катализируемых этими ферментами. К первому относятся реакции, в которых фермент осуществляет прямое окисление с участием кислорода, т.е. дегидрирование (отщепление электронов и протонов) исходного субстрата или промежуточного метаболита. К ферментам этой группы относятся оксидазы Ь- и О-аминокислот, глициноксидаза, альдегидоксидаза, ксантиноксидаза и др. Вторая группа реакций, катализируемых флавопротеинами, характеризуется переносом электронов и протонов не от исходного субстрата, а от восстановленных пиридиновых коферментов. Ферменты этой группы играют главную роль в биологическом окислении. В каталитическом цикле изоаллоксазиновый остаток ФАД или ФМН подвергается обратимому восстановлению с присоединением электронов и атомов водорода к и ФМН и ФАД прочно связываются с белковым компонентом, иногда даже ковалентно, как, например, в молекуле сукцинатдегидрогеназы. [c.224]
Ферменты этой группы играют главную роль в биологическом окислении. В каталитическом цикле изоаллоксазиновый остаток ФАД или ФМН подвергается обратимому восстановлению с присоединением электронов и атомов водорода к и ФМН и ФАД прочно связываются с белковым компонентом, иногда даже ковалентно, как, например, в молекуле сукцинатдегидрогеназы. [c.224]
Изотопный обмен 0 может быть использован для более полного изучения реакций ферментативных превращений. При катализе большая группа ферментов (фосфотрансфераз) расщепляет фосфаты, ответственные за энергозапас, и таким образом осуществляется перенос фосфатной группы или на другой субстрат (киназу) или на окружающую воду (гидролазу). При ферментативном гидролизе нуклеозидтрифосфата (НТФ), ответственного за энергозапас клетки, в качестве промежуточного продукта возникает такое состояние фосфатной группы, при котором связь с ангидридом фосфорной кислоты уже расщеплена, однако фосфатный остаток Р,- еще связан с нукле-озиддифосфатом (НДФ) и присоединен к ферменту Е. Формально эту реакцию можно представить в виде следующего уравнения [c.86]
Формально эту реакцию можно представить в виде следующего уравнения [c.86]
Ферменты переноса — трансферазы. Ферменты этой группы катализируют перенос атомных группировок одного соединения на другое, например, аминоферазы производят переаминирова-ние фосфоферазы катализируют перенос остатков фосфорной кислоты. [c.83]
К какой органической группе принадлежит фермент? | Образование
Дэвид Х. Нгуен, доктор философии.
Среди органических макромолекул ферменты относятся к категории белков. Белки отличаются от углеводов, нуклеиновых кислот и липидов тем, что белок состоит из аминокислот. Аминокислоты соединяются в цепочку, которая может складываться в трехмерную форму. Ферменты — это особый тип белка, потому что они катализируют реакции, то есть ускоряют химические реакции, не меняя самих себя в процессе.Ферменты работают только тогда, когда они имеют правильную трехмерную форму, поэтому такие факторы, как экстремальные температуры и условия pH, заставят фермент разворачиваться и больше не работать.
Аминокислоты — строительные блоки
Ферменты — это белки, то есть они состоят из аминокислот. Есть 20 различных типов аминокислот. Каждый тип аминокислоты определяется так называемой боковой группой. Аминокислоты соединяются вместе, образуя длинные цепи, называемые полипептидами. Затем части этих цепочек складываются во вторичные структуры: спиральные или пластинчатые.Затем вторичные структуры стягиваются вместе, образуя третичную структуру фермента. Третичная структура фермента удерживается вместе за счет взаимодействия боковых групп. Активность фермента также становится возможной благодаря определенным боковым группам аминокислот, которые расположены в его активном центре, части фермента, напоминающей ротовую полость.
Влияние температуры
Поскольку ферменты являются белками, на них сильно влияет температура. Для правильного функционирования ферменты должны иметь трехмерную форму.Каждый фермент имеет оптимальную температуру, при которой он лучше всего проявляет свою активность. Ниже и выше этой температуры фермент отключается. Человеческие ферменты лучше всего работают при температуре тела, которая составляет 37,5 градусов по Цельсию (99,5 градусов по Фаренгейту). Большинство ферментов животных теряют активность, когда температура превысит 40 градусов по Цельсию (104 градуса по Фаренгейту), поскольку при этой температуре атомы в белке слишком сильно вибрируют, чтобы сохранить трехмерную форму.
Ниже и выше этой температуры фермент отключается. Человеческие ферменты лучше всего работают при температуре тела, которая составляет 37,5 градусов по Цельсию (99,5 градусов по Фаренгейту). Большинство ферментов животных теряют активность, когда температура превысит 40 градусов по Цельсию (104 градуса по Фаренгейту), поскольку при этой температуре атомы в белке слишком сильно вибрируют, чтобы сохранить трехмерную форму.
Влияние pH
Изменения pH также могут изменить форму фермента, как и других белков.PH — это показатель кислотности или щелочности раствора. Боковые группы некоторых аминокислот являются кислотными группами, что означает, что они могут получить или потерять атом водорода. Когда они отказываются от своего атома водорода, у них появляется отрицательный заряд, который они используют для привлечения положительно заряженных аминокислот. Это притяжение называется ионной связью и важно для удержания трехмерной формы фермента. Однако, когда pH окружающей среды становится слишком кислым, а это означает, что имеется много свободно плавающих ионов водорода, ионы водорода могут снова перейти на отрицательно заряженные кислотные группы. Это заставляет кислотную группу терять свой отрицательный заряд, что означает, что она больше не может выполнять ионную связь. В результате фермент может разворачиваться.
Это заставляет кислотную группу терять свой отрицательный заряд, что означает, что она больше не может выполнять ионную связь. В результате фермент может разворачиваться.
Влияние солей тяжелых металлов
Еще одним фактором, влияющим на белки, являются соли тяжелых металлов. Соли тяжелых металлов содержат ионы тяжелых металлов, таких как ртуть (Hg ++), свинец (Pb ++) и серебро (Ag +). Эти ионы имеют сильные положительные заряды и могут разрушать солевые мостики, что является еще одним названием ионных связей между боковыми группами аминокислот. Ионы тяжелых металлов могут втиснуться между ионной связью и разорвать ее, образуя новые ионные связи с партнерами, которые были частью старой ионной связи, толкая вещи туда и сюда.
Ссылки
Ресурсы
Писатель Биография
Дэвид Х. Нгуен имеет докторскую степень, биолог-онколог и научный писатель. Его специальность — биология опухолей. Он также сильно интересуется тесной взаимосвязью между социальной несправедливостью и неравенством в отношении здоровья от рака, что особенно влияет на этнические меньшинства и порабощенные народы. Он является автором электронной книги Kindle «Советы по выживанию в аспирантуре и профессиональной школе».
Он является автором электронной книги Kindle «Советы по выживанию в аспирантуре и профессиональной школе».
Определение и классификация ферментов — Creative Enzymes
Определение
Фермент — это белок или РНК, продуцируемые живыми клетками, которые обладают высокой специфичностью и обладают высокой каталитической способностью по отношению к своим субстратам.Ферменты — очень важный тип макромолекулярных биологических катализаторов. Благодаря действию ферментов химические реакции в организмах также могут осуществляться эффективно и специфично в мягких условиях.
Номенклатура
Номенклатура ферментов определяется их субстратами или катализируемыми химическими реакциями, и «аза» обычно добавляется в качестве суффикса. Ферменты могут быть проиндексированы буквами и цифрами в соответствии с Международным союзом биохимии и молекулярной биологии: буква ЕС плюс четыре числа, представляющих четыре элемента. Первое число обозначает ферменты, которые классифицируются по механизму ферментативной реакции.
Первое число обозначает ферменты, которые классифицируются по механизму ферментативной реакции.
Классификация
В зависимости от типа реакций, которые катализируют ферменты, ферменты подразделяются на семь категорий: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы и транслоказы. Оксидоредуктазы, трансферазы и гидролазы являются наиболее распространенными формами ферментов. Отдельные классы ферментов далее систематически классифицируются на основе химического названия субстрата и механизма его реакции.
| Класс ферментов | Тип реакции | Описание |
| EC 1 Оксидоредуктазы | Катализируют окислительно-восстановительную реакцию и могут быть разделены на оксидазу и редуктазу. | |
| EC 2 Трансферазы | Катализируйте перенос или обмен определенных групп между некоторыми субстратами | |
| EC 3 Гидролазы | Ускоряют гидролиз субстратов | |
| EC 4 Лиасы | Содействовать удалению группы с субстрата, чтобы оставить реакцию двойной связи, или катализировать ее обратную реакцию | |
| EC 5 Изомеразы | Облегчить преобразование изомеров, геометрических изомеров или оптических изомеров. | |
| EC 6 Лигазы | Катализируйте синтез двух молекулярных субстратов в одно молекулярное соединение с энергией высвобождения | |
| EC 7 Транслоказы | Катализируйте движение ионов или молекул через мембраны или их разделение внутри мембран |
В соответствии с принципом единой классификации ферментов, опубликованным Международным обществом биохимии, каждую группу ферментов в перечисленных выше семи категориях можно далее разделить на несколько подгрупп в соответствии с характеристиками функциональных групп или связей в субстратах.Чтобы более точно показать свойства субстратов или реагентов, каждый подкласс далее делится на подклассы и непосредственно содержит определенное количество ферментов.
Более того, по молекулярному составу ферменты можно разделить на чистые ферменты и связывающие ферменты. Ферменты, содержащие только белок, называются чистыми ферментами. Связывающие ферменты состоят из белков и кофакторов. Только когда эти два компонента объединены, фермент может проявлять каталитическую активность.
Рекомендуемые товары
Ферменты
Ферменты с различными каталитическими механизмами
— обзор | Темы ScienceDirect
2.1 Введение
Ферменты — это активные белки (кроме РНКазы), которые могут катализировать биохимические реакции. Это биомолекулы, необходимые как для синтеза, так и для реакций разложения живыми организмами. Все живые организмы создаются и поддерживаются этими ферментами, которые действительно называют биологическими катализаторами, обладающими способностью превращать конкретное соединение (в качестве субстрата) в продукты с более высокими скоростями реакции.Подобно химическим катализаторам, ферменты увеличивают скорость реакции за счет снижения ее энергии активации ( E a ), следовательно, продукты образуются быстрее, а реакции быстрее достигают состояния равновесия. Скорость большинства ферментативных реакций в миллионы раз выше, чем скорость некаталитических реакций. Они могут выполнять преобразование за минуты или даже за секунды, что в противном случае может занять сотни лет (Dalby, 2003; Otten and Quax, 2005). Известно, что ферменты катализируют около 4000 биохимических реакций у живых существ (Bairoch, 2000).Например, лактаза представляет собой гликозидгидролазу, которая способна гидролизовать лактозу (молочный сахар) на составляющие ее мономеры галактозу и глюкозу. Он вырабатывается различными микроорганизмами, а также в тонком кишечнике человека и других млекопитающих, помогая полностью переваривать молоко. Ферменты также являются энантиоселективными катализаторами, которые можно использовать либо при разделении энантиомеров из рацемической смеси, либо в синтезе хиральных соединений.
Скорость большинства ферментативных реакций в миллионы раз выше, чем скорость некаталитических реакций. Они могут выполнять преобразование за минуты или даже за секунды, что в противном случае может занять сотни лет (Dalby, 2003; Otten and Quax, 2005). Известно, что ферменты катализируют около 4000 биохимических реакций у живых существ (Bairoch, 2000).Например, лактаза представляет собой гликозидгидролазу, которая способна гидролизовать лактозу (молочный сахар) на составляющие ее мономеры галактозу и глюкозу. Он вырабатывается различными микроорганизмами, а также в тонком кишечнике человека и других млекопитающих, помогая полностью переваривать молоко. Ферменты также являются энантиоселективными катализаторами, которые можно использовать либо при разделении энантиомеров из рацемической смеси, либо в синтезе хиральных соединений.
Люди осознали важность ферментов тысячи лет назад; осветление и фильтрация вин и пива — самые ранние примеры применения промышленных ферментов.Ферменты использовались в пивоварении, выпечке и производстве алкоголя с доисторических времен; однако они не называли их ферментами. Одно из самых ранних письменных упоминаний о ферментах встречается в греческих эпических поэмах Гомера, датируемых примерно 800 г. до н.э., где упоминается, что ферменты использовались при производстве сыра. Японцы также использовали природные ферменты в производстве ферментированных продуктов, таких как саке, японский шнапс, сваренный из риса, уже более тысячи лет. Некоторые ферменты были разработаны природой для образования сложных молекул из более простых, в то время как другие были разработаны для разбиения сложных молекул на более простые, а также некоторые модифицировали молекулы.Эти реакции включают образование и разрыв химических связей в компонентах. Благодаря своей «специфичности», свойству фермента, которое позволяет ему распознавать конкретный субстрат, для которого они предназначены, они полезны для промышленных процессов и способны катализировать реакцию между определенными химическими веществами, даже если они присутствуют в смесях. со многими химикатами. Эти ферменты экологически безопасны, натуральны и очень безопасно применяются в пищевой и даже фармацевтической промышленности.
Одно из самых ранних письменных упоминаний о ферментах встречается в греческих эпических поэмах Гомера, датируемых примерно 800 г. до н.э., где упоминается, что ферменты использовались при производстве сыра. Японцы также использовали природные ферменты в производстве ферментированных продуктов, таких как саке, японский шнапс, сваренный из риса, уже более тысячи лет. Некоторые ферменты были разработаны природой для образования сложных молекул из более простых, в то время как другие были разработаны для разбиения сложных молекул на более простые, а также некоторые модифицировали молекулы.Эти реакции включают образование и разрыв химических связей в компонентах. Благодаря своей «специфичности», свойству фермента, которое позволяет ему распознавать конкретный субстрат, для которого они предназначены, они полезны для промышленных процессов и способны катализировать реакцию между определенными химическими веществами, даже если они присутствуют в смесях. со многими химикатами. Эти ферменты экологически безопасны, натуральны и очень безопасно применяются в пищевой и даже фармацевтической промышленности. Тем не менее, ферменты — это белки, которые, как и любой другой белок, могут вызывать и вызвали в прошлом аллергические реакции, поэтому при их производстве и применении необходимы защитные меры.
Тем не менее, ферменты — это белки, которые, как и любой другой белок, могут вызывать и вызвали в прошлом аллергические реакции, поэтому при их производстве и применении необходимы защитные меры.
Ферментные технологии — это постоянно развивающаяся отрасль «науки и технологий». Благодаря вмешательству и влиянию биотехнологии и биоинформатики появляются постоянно новые или улучшенные области применения ферментов. Вместе с новыми применениями возникает потребность в ферментах с улучшенными свойствами.Разработка коммерческих ферментов — это специализированный бизнес, которым обычно занимаются компании, обладающие высокой квалификацией в следующих областях:
- ●
Скрининг новых и улучшенных ферментов
- ●
Отбор микроорганизмов и улучшение штаммов для качественного и количественного улучшения
- ●
Ферментация для производства ферментов
- ●
Крупномасштабная очистка ферментов
- ●
Формулировка ферментов для продажи
Технологии ферментов предлагают возможность замены отраслей и процессов. использование агрессивных химикатов с мягкими и экологически чистыми ферментными процессами.Известно около 3000 ферментов, из которых только 150–170 используются в промышленности. В настоящее время в эту зеленую эру биологическим путем производится только 5% химических продуктов. Однако экономически целесообразные и экологически безопасные ферментативные процессы появляются как альтернатива физико-химическим и механическим процессам. В зависимости от различных областей применения промышленные ферменты можно разделить на: (1) ферменты в пищевой промышленности, (2) ферменты для технологических добавок, (3) ферменты в качестве промышленных биокатализаторов, (4) ферменты в генной инженерии и (5) ) Ферменты в косметике.
использование агрессивных химикатов с мягкими и экологически чистыми ферментными процессами.Известно около 3000 ферментов, из которых только 150–170 используются в промышленности. В настоящее время в эту зеленую эру биологическим путем производится только 5% химических продуктов. Однако экономически целесообразные и экологически безопасные ферментативные процессы появляются как альтернатива физико-химическим и механическим процессам. В зависимости от различных областей применения промышленные ферменты можно разделить на: (1) ферменты в пищевой промышленности, (2) ферменты для технологических добавок, (3) ферменты в качестве промышленных биокатализаторов, (4) ферменты в генной инженерии и (5) ) Ферменты в косметике.
Сегодня ферменты рассматриваются как хлеб с маслом биотехнологии, потому что они являются основными инструментами для нескольких биотехнологических методов (ограничение генов, лигирование, клонирование и т. Д.), Биопроцессов (ферментация и культивирование клеток) и в аналитических исследованиях человека. и зоотерапия в качестве лекарств или мишеней для лекарств. Кроме того, они находят применение в ряде других отраслей, таких как пищевая и кормовая, текстильная, очистка сточных вод и отходов, бумага, кожевенное производство, выпечка, пивоварение, молочная промышленность, фармацевтика, кондитерские изделия и т. Д.(Pandey et al., 2006).
и зоотерапия в качестве лекарств или мишеней для лекарств. Кроме того, они находят применение в ряде других отраслей, таких как пищевая и кормовая, текстильная, очистка сточных вод и отходов, бумага, кожевенное производство, выпечка, пивоварение, молочная промышленность, фармацевтика, кондитерские изделия и т. Д.(Pandey et al., 2006).
Ферменты, используемые сегодня, также встречаются у животных (пепсин, трипсин, панкратин и химозин) и растений (папаин, бромелайн и фицин), но большинство из них имеют микробное происхождение, например глюкоамилаза, α-амилаза, пектиназы. и т. д. Преимущество использования микробов для производства ферментов заключается в их более высоких способностях к росту, более высокой продуктивности и более простом генетическом манипулировании ими для увеличения производства ферментов и т. д. Ферменты, полученные из микробов, называются микробными ферментами.Микробы в основном используются в промышленности для производства ферментов. Более того, микробные ферменты поставляются, хорошо стандартизированы и продаются несколькими конкурирующими компаниями по всему миру. В зависимости от типа процесса ферменты могут использоваться в растворимой форме (протеазы животных и липазы на кожевенных заводах) и в иммобилизованной форме (изомеризация глюкозы во фруктозу с помощью глюкозоизомеразы).
В зависимости от типа процесса ферменты могут использоваться в растворимой форме (протеазы животных и липазы на кожевенных заводах) и в иммобилизованной форме (изомеризация глюкозы во фруктозу с помощью глюкозоизомеразы).
Типы ферментов и как они работают
О ферментах:
Ферменты — это очень эффективные и специфические белки-катализаторы, которые реагируют с одним или несколькими типами субстратов в биохимических реакциях и ответственны за осуществление почти всех химических реакций в живых организмах.Ферменты ускоряют реакции, обеспечивая альтернативный путь реакции с более низкой энергией активации. Без ферментов реакции происходят со скоростью, слишком медленной для скорости метаболизма, а это означает, что они ускоряют химические реакции в живых существах.
Существует 2 типа ферментов: одни, которые помогают соединять определенные молекулы вместе с образованием новых молекул, и другие, которые помогают разбивать определенные молекулы на отдельные молекулы. Ферменты также играют много важных ролей вне клетки.Один из лучших примеров — пищеварительная система. Например, это ферменты в вашей пищеварительной системе, которые расщепляют пищу в вашей пищеварительной системе, расщепляют пищу на небольшие молекулы, которые могут быть поглощены организмом. Некоторые ферменты в пищеварительной системе расщепляют крахмал, некоторые белки, а другие — жиры. Ферменты, используемые для переваривания пищи, являются внеклеточными, поскольку они расположены вне наших клеток, а ферменты внутри наших клеток являются внутриклеточными ферментами. Ферменты используются во ВСЕХ химических реакциях живых существ; это включает дыхание, фотосинтез, рост движений, избавление от токсичных химических веществ в печени и так далее.Ферменты — это белки, которые для активности должны иметь правильную структуру. Они очень легко подвержены воздействию тепла, pH и ионов тяжелых металлов.
Ферменты также играют много важных ролей вне клетки.Один из лучших примеров — пищеварительная система. Например, это ферменты в вашей пищеварительной системе, которые расщепляют пищу в вашей пищеварительной системе, расщепляют пищу на небольшие молекулы, которые могут быть поглощены организмом. Некоторые ферменты в пищеварительной системе расщепляют крахмал, некоторые белки, а другие — жиры. Ферменты, используемые для переваривания пищи, являются внеклеточными, поскольку они расположены вне наших клеток, а ферменты внутри наших клеток являются внутриклеточными ферментами. Ферменты используются во ВСЕХ химических реакциях живых существ; это включает дыхание, фотосинтез, рост движений, избавление от токсичных химических веществ в печени и так далее.Ферменты — это белки, которые для активности должны иметь правильную структуру. Они очень легко подвержены воздействию тепла, pH и ионов тяжелых металлов.
Каталитическая активность фермента рибонуклеопротеина находится в белковой части, но для некоторых каталитическая активность проявляется в части РНК. Катализатор — это любое вещество, которое ускоряет химическую реакцию без изменения самого себя. Катализатор можно использовать снова и снова в химической реакции, и он не расходуется.
Катализатор — это любое вещество, которое ускоряет химическую реакцию без изменения самого себя. Катализатор можно использовать снова и снова в химической реакции, и он не расходуется.
Ферменты снижают количество энергии активации, необходимой для связывания с реагентами реакции, которую они катализируют, таким образом ускоряя реакцию и могут обрабатывать миллионы молекул в секунду.Ферменты обычно представляют собой большие белки с высокой молекулярной массой, которые позволяют реакциям протекать в условиях, которые организм может переносить.
Номенклатура ферментов основана на том, с чем и как реагирует фермент, а также на конечной азе.
Ферменты должны преодолеть барьер энергии активации.
Ферменты изменяют ход реакции, что снижает энергию активации и ускоряет ее. Чем больше мы увеличиваем концентрацию фермента, тем выше скорость некаталитических реакций.Ферменты, которые являются катализируемыми реакциями, также увеличивают скорость реакции при более высоком уровне концентрации, но до определенной точки, называемой Vmax, что означает, что фермент достиг максимальной точки. Реакция ограничена как концентрацией фермента, так и субстрата. Ферменты в качестве катализаторов принимают участие в реакциях, которые обеспечивают альтернативный путь реакции. Ферменты не претерпевают постоянных изменений и остаются неизменными по окончании реакции. Они изменяют только скорость реакции, но не положение равновесия.Ферменты в качестве катализаторов обладают высокой селективностью, катализируя только определенные реакции, обусловленные формой молекулы фермента.
Реакция ограничена как концентрацией фермента, так и субстрата. Ферменты в качестве катализаторов принимают участие в реакциях, которые обеспечивают альтернативный путь реакции. Ферменты не претерпевают постоянных изменений и остаются неизменными по окончании реакции. Они изменяют только скорость реакции, но не положение равновесия.Ферменты в качестве катализаторов обладают высокой селективностью, катализируя только определенные реакции, обусловленные формой молекулы фермента.
Ферменты содержат часть глобулярного белка, называемую апоферментом, и небелковую часть, называемую кофактором, или простетической группой, или активатором иона металла. Изменения температуры и pH имеют большое влияние на внутри- и межмолекулярные связи, которые удерживают белковые части во вторичных и третичных структурах.
Примеры кофакторов: 1. Протезная группа, постоянно связанная с ферментом.2. Активаторная группа, которая представляет собой катионы (положительно заряженные ионы металлов) и временно связываются с активным центром фермента. 3. Коферменты, обычно витамины или сделанные из витаминов, которые не связаны постоянно с молекулой фермента, но временно соединяются с комплексом фермент-субстрат. Для проявления каталитической активности ферментам требуется присутствие кофакторов. Весь этот активный комплекс называется холоэнзимом.
3. Коферменты, обычно витамины или сделанные из витаминов, которые не связаны постоянно с молекулой фермента, но временно соединяются с комплексом фермент-субстрат. Для проявления каталитической активности ферментам требуется присутствие кофакторов. Весь этот активный комплекс называется холоэнзимом.
Без ферментов нашему кишечнику потребовались бы недели, чтобы переваривать нашу пищу, наши мышцы, нервы и кости не работали бы должным образом и так далее…
Оксидоредуктазы:
Все ферменты, катализирующие оксидо-восстановление, относятся к этому классу.Окисленный субстрат рассматривается как донор водорода или электронов. Классификация основана на «донор: акцептор оксидоредуктазы». Общее название — «дегидрогеназа», везде, где это возможно; в качестве альтернативы можно использовать «акцепторную редуктазу». «Оксидаза» используется только в том случае, если O 2 является акцептором. В некоторых случаях классификация затруднена из-за отсутствия специфичности в отношении акцептора.
Трансферазы:
Трансферазы — это ферменты, которые переносят группу, например метильную группу или гликозильную группу, от одного соединения (обычно рассматриваемого как донор) к другому соединению (обычно рассматриваемому как акцептор).Классификация основана на схеме «донор: акцепторная групптрансфераза». Обычные названия обычно образуются как «акцепторная групптрансфераза» или «донорская групптрансфераза». Во многих случаях донор представляет собой кофактор (кофермент), несущий переносимую группу. Аминотрансферазы представляют собой особый случай.
Гидролазы:
Эти ферменты катализируют гидролиз различных связей. Некоторые из этих ферментов создают проблемы, потому что они обладают очень широкой специфичностью, и нелегко решить, являются ли два препарата, описанные разными авторами, одинаковыми или они должны быть указаны в разных статьях.В то время как систематическое название всегда включает «гидролаза», общее название в большинстве случаев образовано названием субстрата с суффиксом -аза. Понятно, что название субстрата с этим суффиксом, а не другим показателем, означает гидролитический фермент. Следует отметить, что у пептидаз есть рекомендуемые названия, а не общие названия.
Понятно, что название субстрата с этим суффиксом, а не другим показателем, означает гидролитический фермент. Следует отметить, что у пептидаз есть рекомендуемые названия, а не общие названия.
Лиазы:
Лиазы — это ферменты, которые расщепляют C-C, C-O, C-N и другие связи способами, отличными от гидролиза или окисления. Они отличаются от других ферментов тем, что два (или более) субстрата участвуют в одном направлении реакции, но на одно соединение меньше в другом направлении.При воздействии на одиночный субстрат молекула удаляется, и это создает новую двойную связь или новое кольцо. Систематическое название образовано по «субстратная группа-лиаза». В общих названиях используются такие выражения, как декарбоксилаза, альдолаза и т. Д. «Дегидратаза» используется для тех ферментов, которые выводят воду. В случаях, когда обратная реакция является более важной или единственной, которую нужно продемонстрировать, в названии может использоваться «синтаза».
Лигазы:
Лигазы — это ферменты, которые катализируют соединение двух молекул с сопутствующим гидролизом дифосфатной связи в АТФ или подобном трифосфате. «Лигаза» часто используется для общего названия, но в некоторых случаях используется «синтаза» или «карбоксилаза». «Синтетаза» может использоваться вместо «синтазы» для ферментов этого класса.
«Лигаза» часто используется для общего названия, но в некоторых случаях используется «синтаза» или «карбоксилаза». «Синтетаза» может использоваться вместо «синтазы» для ферментов этого класса.
белков как ферменты
Важным моментом в отношении ферментов является то, что они очень четко определяют, что они могут катализировать. Даже небольшие изменения в молекуле реагента могут помешать ферменту катализировать его реакцию. Причина этого кроется в активном центре , присутствующем в ферменте.. .
Активные сайты
Активные центры — это трещины или впадины на поверхности фермента, вызванные тем, как белок складывается в свою третичную структуру. Молекулы правильной формы и с правильным расположением привлекательных групп (см. Ниже) могут вписаться в эти активные участки. Другие молекулы не подходят или не имеют нужных групп для связывания с поверхностью активного сайта.
Обычная аналогия — ключ, вставляемый в замок. Чтобы ключ работал правильно, он должен точно входить в замок.
Чтобы ключ работал правильно, он должен точно входить в замок.
В химии мы бы описали молекулу, которая действительно будет реагировать (фиолетовая на диаграмме), как реагент . В биологии и биохимии реагент в ферментативной реакции известен как субстрат .
Вы не должны слишком буквально фотографировать то, как субстрат входит в состав своего фермента.Не менее важны, чем физическая форма субстрата, связи, которые он может образовывать с ферментом.
Ферменты — это белковые молекулы — длинные цепочки аминокислотных остатков. Помните, что вдоль всех цепей торчат боковые группы аминокислот — группы «R», о которых мы говорили на странице о структуре белка.
Активные сайты, конечно же, имеют эти группы «R», которые выстраивают их тоже — обычно от 3 до 12 на активном сайте. На следующей диаграмме показан воображаемый активный сайт:
Помните, что эти группы «R» содержат свойства, отвечающие за третичную структуру белков. Например, они могут содержать ионные группы, такие как -NH 3 + или -COO —, или -ОН-группы, которые могут связывать водородные связи, или углеводородные цепи или кольца, которые могут вносить вклад в силы Ван-дер-Ваальса.
Например, они могут содержать ионные группы, такие как -NH 3 + или -COO —, или -ОН-группы, которые могут связывать водородные связи, или углеводородные цепи или кольца, которые могут вносить вклад в силы Ван-дер-Ваальса.
Группы, подобные этим, помогают субстрату прикрепляться к активному центру, но только если молекула субстрата имеет расположение групп в нужных местах для взаимодействия с группами на ферменте.
На диаграмме показан возможный набор взаимодействий с участием двух ионных связей и водородной связи.
Группы, отмеченные знаками + или -, очевидны. Те, в которых есть буквы «H», представляют собой группы, способные образовывать водородные связи. Возможно, что одна или несколько неиспользуемых групп «R» в активном центре также могут помочь с притяжениями Ван-дер-Ваальса между ними и субстратом.
Если бы расположение групп на активном центре или субстрате было хотя бы немного другим, связывание почти наверняка не было бы таким хорошим — и в этом смысле другой субстрат не подходил бы к активному центру фермента.
Этот процесс реакции катализатора с подложкой и, в конечном итоге, образования продуктов часто обозначают следующим образом:
. . . где E — фермент, S — субстрат, а P — продукты.
Образование комплекса обратимо — субстрат, очевидно, может снова отколоться, прежде чем он превратится в продукты. Второй этап показан как односторонний, но в некоторых случаях может быть обратимым. Это будет зависеть от энергетики реакции.
Так почему же присоединение к ферменту увеличивает скорость, с которой субстрат превращается в продукты?
Совершенно не очевидно, почему это должно быть — и большинство источников, предоставляющих информацию на этом вводном уровне, просто замалчивают ее или говорят об этом в расплывчатых общих терминах (это то, что я буду вынужден сделать, потому что я могу Нет простого примера, о котором можно было бы поговорить!).
Катализаторы в целом (и ферменты не исключение) работают, обеспечивая реакцию по пути с более низкой энергией активации. Присоединение субстрата к активному центру должно позволять электронам двигаться, в результате чего связи разрываются намного легче, чем если бы фермента там не было.
Присоединение субстрата к активному центру должно позволять электронам двигаться, в результате чего связи разрываются намного легче, чем если бы фермента там не было.
Как ни странно, гораздо легче увидеть, что может происходить в других случаях, когда ситуация немного сложнее. . .
Кофакторы ферментов
То, что мы сказали до сих пор, является большим упрощением для большинства ферментов. Большинство ферментов на самом деле не просто чистые белковые молекулы.Чтобы заставить их работать, необходимы другие небелковые кусочки и кусочки. Они известны как кофакторы .
При отсутствии подходящего кофактора фермент не работает. Для тех из вас, кто любит собирать непонятные слова, неактивная молекула белка известна как апофермент . Когда кофактор находится на месте и становится активным ферментом, он называется холоэнзимом .
3. Белки как ферменты — Химия LibreTexts
Эта страница представляет собой введение в то, как белки могут работать как ферменты — биологические катализаторы.
Ферменты как катализаторы
Ферменты в основном представляют собой глобулярные белки — белковые молекулы, третичная структура которых придает молекуле в целом округлую форму шара (хотя, возможно, в некоторых случаях это может быть очень сжатый шар). Другой тип белков (волокнистые белки) имеет длинные тонкие структуры и обнаруживается в таких тканях, как мышцы и волосы. Нас не интересуют те, кто в этой теме.
Эти глобулярные белки могут быть удивительно активными катализаторами. Вы, вероятно, знакомы с использованием катализаторов, таких как оксид марганца (IV), при разложении перекиси водорода с образованием кислорода и воды.Фермент каталаза также сделает это, но с впечатляющей скоростью по сравнению с неорганическими катализаторами. Одна молекула каталазы может разлагать почти сто тысяч молекул перекиси водорода каждую секунду. Это очень впечатляет! Это модель каталазы, демонстрирующая глобулярную структуру — немного похожую на спутанную массу струны:
Важным моментом в отношении ферментов является то, что они очень четко определяют, что они могут катализировать. Даже небольшие изменения в молекуле реагента могут помешать ферменту катализировать его реакцию.Причина этого кроется в активном центре фермента. . .
Даже небольшие изменения в молекуле реагента могут помешать ферменту катализировать его реакцию.Причина этого кроется в активном центре фермента. . .
Активные сайты
Активные центры — это трещины или впадины на поверхности фермента, вызванные тем, как белок складывается в свою третичную структуру. Молекулы правильной формы и с правильным расположением привлекательных групп (см. Ниже) могут вписаться в эти активные участки. Другие молекулы не подходят или не имеют нужных групп для связывания с поверхностью активного сайта.
Обычная аналогия — ключ, вставляемый в замок. Чтобы ключ работал правильно, он должен точно входить в замок.
В химии мы бы описали молекулу, которая действительно будет реагировать (фиолетовая на диаграмме), как реагент. В биологии и биохимии реагент ферментативной реакции известен как субстрат.
Вы не должны слишком буквально фотографировать то, как субстрат входит в состав своего фермента. Не менее важны, чем физическая форма субстрата, связи, которые он может образовывать с ферментом.
Не менее важны, чем физическая форма субстрата, связи, которые он может образовывать с ферментом.
Ферменты — это белковые молекулы — длинные цепочки аминокислотных остатков. Помните, что вдоль всех цепей торчат боковые группы аминокислот — группы «R», о которых мы говорили на странице о структуре белка.
Активные сайты, конечно же, имеют эти группы «R», которые выстраивают их тоже — обычно от 3 до 12 на активном сайте. На следующей диаграмме показан воображаемый активный сайт:
Помните, что эти группы «R» содержат свойства, отвечающие за третичную структуру белков.Например, они могут содержать ионные группы, такие как -NH 3 + или -COO —, или -ОН-группы, которые могут связывать водородные связи, или углеводородные цепи или кольца, которые могут вносить вклад в силы Ван-дер-Ваальса.
Группы, подобные этим, помогают субстрату прикрепляться к активному центру, но только если молекула субстрата имеет расположение групп в нужных местах для взаимодействия с группами на ферменте.
На диаграмме показан возможный набор взаимодействий с участием двух ионных связей и водородной связи.
Группы, отмеченные знаками + или -, очевидны. Те, в которых есть буквы «H», представляют собой группы, способные образовывать водородные связи. Возможно, что одна или несколько неиспользуемых групп «R» в активном центре также могут помочь с притяжениями Ван-дер-Ваальса между ними и субстратом.
Если бы расположение групп на активном центре или субстрате было хотя бы немного другим, связывание почти наверняка не было бы таким хорошим — и в этом смысле другой субстрат не подходил бы к активному центру фермента.
Этот процесс реакции катализатора с подложкой и, в конечном итоге, образования продуктов часто обозначают следующим образом:
. . . где E — фермент, S — субстрат, а P — продукты.
Образование комплекса обратимо — субстрат, очевидно, может снова отколоться, прежде чем он превратится в продукты. Второй этап показан как односторонний, но в некоторых случаях может быть обратимым. Это будет зависеть от энергетики реакции.
Второй этап показан как односторонний, но в некоторых случаях может быть обратимым. Это будет зависеть от энергетики реакции.
Так почему же присоединение к ферменту увеличивает скорость, с которой субстрат превращается в продукты?
Совершенно не очевидно, почему это должно быть — и большинство источников, предоставляющих информацию на этом вводном уровне, просто замалчивают ее или говорят об этом в расплывчатых общих терминах (это то, что я буду вынужден сделать, потому что я могу Нет простого примера, о котором можно было бы поговорить!).
Катализаторы в целом (и ферменты не исключение) работают, обеспечивая реакцию по пути с более низкой энергией активации.Присоединение субстрата к активному центру должно позволять электронам двигаться, в результате чего связи разрываются намного легче, чем если бы фермента там не было.
Как ни странно, гораздо легче увидеть, что может происходить в других случаях, когда ситуация немного сложнее. . .
Кофакторы ферментов
То, что мы сказали до сих пор, является большим упрощением для большинства ферментов. Большинство ферментов на самом деле не просто чистые белковые молекулы. Чтобы заставить их работать, необходимы другие небелковые кусочки и кусочки.Они известны как кофакторы.
Большинство ферментов на самом деле не просто чистые белковые молекулы. Чтобы заставить их работать, необходимы другие небелковые кусочки и кусочки.Они известны как кофакторы.
При отсутствии подходящего кофактора фермент не работает. Для тех из вас, кто любит собирать непонятные слова, неактивная молекула белка известна как апофермент. Когда кофактор находится на месте и становится активным ферментом, его называют холоэнзимом.
Есть два принципиально разных типа кофакторов. Некоторые из них прочно связаны с молекулой белка, так что они становятся частью фермента — их называют простетическими группами.
Некоторые из них полностью свободны от фермента и прикрепляются к активному центру вместе с субстратом — их называют коферментами.
Группы протезирования
Протезные группы могут быть такими простыми, как отдельный ион металла, связанный в структуре фермента, или могут быть более сложной органической молекулой (которая также может содержать ион металла). Ферменты карбоангидраза и каталаза являются простыми примерами этих двух типов.
Ферменты карбоангидраза и каталаза являются простыми примерами этих двух типов.
Примечание
Закон идеального газа легко запомнить и применить при решении проблем, если вы получите правильные значения a
Ионы цинка в карбоангидразе
Карбоангидраза — это фермент, который катализирует превращение диоксида углерода в ионы гидрокарбоната (или наоборот) в клетке.(Если вы смотрите это в другом месте, вы обнаружите, что биохимики, как правило, упорно называют гидрокарбонат своим старым именем, бикарбонат!)
На самом деле, существует целое семейство угольных ангидраз, основанных на разных белках, но все они имеют ион цинка, связанный в активном центре. В этом случае механизм понятен и прост. Мы рассмотрим это подробнее, потому что это хорошая иллюстрация того, как работают ферменты.
Ион цинка связан с белковой цепью через три звена, разделяющих остатки гистидина в цепи — показаны розовым цветом на изображении одной из версий карбоангидразы. Цинк также присоединен к группе -ОН — на рисунке красным цветом обозначен кислород, а белым — водород.
Цинк также присоединен к группе -ОН — на рисунке красным цветом обозначен кислород, а белым — водород.
Структура аминокислоты гистидина. . .
. . . а когда он является частью белковой цепи, он соединяется следующим образом:
Если вы посмотрите на модель расположения вокруг иона цинка на картинке выше, вы, по крайней мере, сможете выделить кольцевую часть из трех молекул.Ион цинка связан с этими гистидиновыми кольцами посредством дативных ковалентных (координационно-ковалентных) связей от неподеленных пар на атомах азота. Упрощение структуры вокруг цинка:
Расположение четырех групп вокруг цинка приблизительно четырехгранное. Обратите внимание, что я исказил обычное примерно тетраэдрическое расположение электронных пар вокруг кислорода — это просто для того, чтобы диаграмма была как можно более ясной.
Итак, это структура вокруг цинка.Как это катализирует реакцию между углекислым газом и водой?
Молекула углекислого газа удерживается близлежащей частью активного центра, так что одна из неподеленных пар кислорода указывает прямо на атом углерода в середине молекулы углекислого газа. Присоединение его к ферменту также увеличивает существующую полярность углерод-кислородных связей.
Присоединение его к ферменту также увеличивает существующую полярность углерод-кислородных связей.
Если вы хоть как-то работали над механизмами органических реакций, то, что должно произойти, довольно очевидно.Неподеленная пара образует связь с атомом углерода, и часть одной из связей углерод-кислород разрывается и оставляет атом кислорода с отрицательным зарядом.
Теперь у вас есть ион гидрокарбоната, присоединенный к цинку.
На следующей диаграмме показано, как эта молекула отделяется и заменяется молекулой воды из раствора клетки.
Все, что теперь должно произойти, чтобы вернуть катализатор туда, где он был запущен, — это чтобы вода потеряла ион водорода.Это переносится другой молекулой воды на соседний аминокислотный остаток с азотом в группе «R» — и, в конечном итоге, посредством серии аналогичных переносов полностью из активного центра. . . . а фермент карбоангидраза может совершать эту последовательность реакций около миллиона раз в секунду. Это замечательный образец молекулярной машины!
Это замечательный образец молекулярной машины!
Группа гема (США: гем) в каталазе
Вспомните модель каталазы с более высокой страницы. . .
В то время я упомянул небелковые группы, которые он содержит, которые показаны розовым на картинке.Это гемовые (США: гем) группы, связанные с белковой молекулой, и важная часть работы каталазы. Гемовая группа — хороший пример протезной группы. Если бы его не было, молекула белка не работала бы в качестве катализатора. Гемовые группы содержат ион железа (III), связанный в кольцевую молекулу — одну из ряда связанных молекул, называемых порфиринами. Железо заблокировано в центре молекулы порфирина посредством дативных ковалентных связей от четырех атомов азота в кольцевой структуре.Существуют разные типы порфиринов, поэтому существуют разные группы гема. Тот, который нас интересует, называется гемом B, а модель группы гема B (с ионом железа (III) серым цветом в центре) выглядит так:
Каталаза выполняет реакцию разложения перекиси водорода на воду и кислород.
Была проделана большая работа над механизмом этой реакции, но я собираюсь дать вам только упрощенную версию, а не описывать ее полностью.Хотя на первый взгляд это выглядит довольно просто, есть много скрытых вещей, которые усложняют его.
По сути, реакция происходит в две стадии и включает изменение степени окисления железа. Легкое изменение степени окисления — одна из основных характеристик переходных металлов. В лаборатории железо обычно имеет два состояния окисления (а также ноль в самом металле), +2 и +3, и легко меняется с одного на другое.
В каталазе изменение от +3 до гораздо менее распространенного +4 и обратно.
На первой стадии происходит реакция между молекулой перекиси водорода и активным центром с образованием:
«Фермент» в уравнении относится ко всему (группе гема и белку), кроме иона железа. «(III)» и «(IV)» представляют собой степени окисления железа в обоих случаях. Это уравнение (и следующее) НЕ являются собственными химическими уравнениями. Это всего лишь краткое изложение наиболее очевидных событий, которые произошли.
Это уравнение (и следующее) НЕ являются собственными химическими уравнениями. Это всего лишь краткое изложение наиболее очевидных событий, которые произошли.
Новое устройство вокруг железа затем вступает в реакцию со второй перекисью водорода, восстанавливая исходную структуру и производя кислород и вторую молекулу воды.
В этом упрощении скрыты другие вещи, которые происходят одновременно — например, остальная часть гемовой группы и некоторые аминокислотные остатки вокруг активного центра также изменяются на каждой стадии реакции.
И если вы задумаетесь о том, что должно произойти с молекулой перекиси водорода в обеих реакциях, это должно быть сложнее, чем можно предположить. Перекись водорода объединяется в H-O-O-H, и все же оба атома водорода присоединяются к одному и тому же кислороду.Это довольно сложно организовать небольшими шагами в механизме, и включает в себя перенос ионов водорода через аминокислотные остатки в активном центре.
Так нужно ли вам помнить все это для химии на этом уровне? Нет, если только ваш учебный план специально не требует этого. По сути, это просто иллюстрация термина «протезная группа».
Это также показывает, что даже в биохимической ситуации переходные металлы ведут себя так же, как и в неорганической химии — они образуют комплексы и меняют свою степень окисления.И если вы хотите проследить за этим, чтобы подробно изучить, что происходит, вы обнаружите те же взаимодействия вокруг активного сайта, которые мы рассматривали в более простом случае карбоиндеразы. (Но, пожалуйста, не тратьте на это время, если нет необходимости — это серьезно сложно!)
Коэнзимы
Коферменты — еще одна форма кофактора. Они отличаются от простетических групп тем, что не прикреплены постоянно к молекуле белка. Вместо этого коферменты прикрепляются к активному центру рядом с субстратом, и в реакцию вовлекаются оба из них.После реакции они оба покидают активный сайт — оба каким-то образом изменились. Простая диаграмма, показывающая субстрат и кофермент вместе в активном центре, может выглядеть так:
Простая диаграмма, показывающая субстрат и кофермент вместе в активном центре, может выглядеть так:
Намного легче понять это на (относительно) простом примере.
НАД + как кофермент с алкогольдегидрогеназой
Алкогольдегидрогеназа — это фермент, запускающий процесс окисления алкоголя (этанола) в крови до безвредных продуктов. Название «дегидрогеназа» предполагает, что она окисляет этанол, удаляя из него водород.
На самом деле реакция происходит между этанолом и коферментом НАД +, прикрепленным бок о бок к активному центру белковой молекулы. НАД + — это кофермент, который обычно используется во всех видах окислительно-восстановительных реакций в клетке.
NAD + обозначает никотинамидадениндинуклеотид. Знак плюс, который является частью его названия, связан с тем, что он несет положительный заряд на атоме азота в структуре.
«Никотинамидная» часть структуры происходит из витамина, имеющего различные значения , включая витамин B3, ниацин или никотиновую кислоту. Несколько важных коферментов получают из витаминов.
Несколько важных коферментов получают из витаминов.
Этанол окисляется в результате реакции с NAD + с помощью активного центра фермента. В конце реакции образуется этаналь (ацетальдегид), и НАД + превращается в другое соединение, известное как НАДН.
Что касается NAD +, он захватил атом водорода вместе с дополнительным электроном, который нейтрализовал заряд. Оба основных продукта — этаналь и НАДН — покидают активный центр и далее обрабатываются в других клеточных реакциях.
Очень ядовитый этаналь сразу окисляется до этановой кислоты с использованием другого фермента, но опять же с использованием НАД + в качестве кофермента. И этановая кислота из этого реагирует через целый набор дальнейших контролируемых ферментами реакций, в конечном итоге превращаясь в диоксид углерода и воду.
А как насчет НАДН? Это сам по себе кофермент, который участвует в реакциях, требующих восстановления. Атом водорода и дополнительный электрон, который он уловил из этанола, переданы чему-то другому. В процессе, конечно, НАДН снова окисляется до НАД +. В общих чертах, для субстрата S, требующего восстановления:
В процессе, конечно, НАДН снова окисляется до НАД +. В общих чертах, для субстрата S, требующего восстановления:
5.2: Ферменты — Биология LibreTexts
Ферменты — это биологические катализаторы, которые ускоряют химические реакции за счет снижения энергии активации. Ферменты — это белки, состоящие из одной или нескольких полипептидных цепей. Ферменты имеют активный центр, который обеспечивает уникальную химическую среду, состоящую из определенных аминокислотных R-групп (остатков).Эта уникальная среда хорошо подходит для преобразования определенных химических реагентов для этого фермента, называемых субстратами, в нестабильные промежуточные продукты, называемые переходными состояниями. Считается, что ферменты и субстраты связываются с индуцированной подгонкой, что означает, что ферменты и субстраты претерпевают незначительные конформационные изменения при контакте с субстратом, что приводит к связыванию. Ферменты связываются с субстратами и катализируют реакции четырьмя различными способами: объединяя субстраты вместе в оптимальной ориентации, нарушая структуру связей субстратов, чтобы связи можно было легче разорвать, обеспечивая оптимальные условия окружающей среды для протекания реакции или непосредственно участвуя в их химическая реакция путем образования временных ковалентных связей с субстратами.
Действие фермента необходимо регулировать таким образом, чтобы в данной клетке в заданное время желаемые реакции катализировались, а нежелательные — нет. Ферменты регулируются клеточными условиями, такими как температура и pH. Они также регулируются своим расположением в клетке, иногда будучи разделенными на части, так что они могут катализировать реакции только при определенных обстоятельствах. Ингибирование и активация ферментов с помощью других молекул — другие важные способы регуляции ферментов.Ингибиторы могут действовать конкурентно, неконкурентоспособно или аллостерически; неконкурентные ингибиторы обычно являются аллостерическими. Активаторы могут также аллостерически усиливать функцию ферментов. Наиболее распространенный метод, с помощью которого клетки регулируют ферменты метаболических путей, — это ингибирование с помощью обратной связи. Во время ингибирования с обратной связью продукты метаболического пути служат ингибиторами (обычно аллостерическими) одного или нескольких ферментов (обычно первый коммитированный фермент пути), участвующих в пути, который их производит.
Ферменты
Вещество, которое помогает протекать химической реакции, — это катализатор , а особые молекулы, которые катализируют биохимические реакции, называются ферментами . Почти все ферменты — это белки, состоящие из цепочек аминокислот, и они выполняют важную задачу по снижению энергии активации химических реакций внутри клетки. Ферменты делают это, связываясь с молекулами реагентов и удерживая их таким образом, чтобы облегчить процессы разрыва и образования связей.Важно помнить, что ферменты не изменяют ∆G реакции. Другими словами, они не меняют того, является ли реакция экзергонической (спонтанной) или эндергонической. Это потому, что они не изменяют свободную энергию реагентов или продуктов. Они только уменьшают энергию активации, необходимую для достижения переходного состояния.
Рис. 1: Ферменты снижают энергию активации реакции, но не изменяют свободную энергию реакции. Здесь сплошная линия на графике показывает энергию, необходимую для превращения реагентов в продукты без катализатора. Пунктирная линия показывает энергию, необходимую для использования катализатора. На этом рисунке должна быть указана свободная энергия Гиббса по оси Y, а вместо deltaH должно быть указано deltaG. Атрибуция: Марк Т. Фаччиотти (собственная работа)
Пунктирная линия показывает энергию, необходимую для использования катализатора. На этом рисунке должна быть указана свободная энергия Гиббса по оси Y, а вместо deltaH должно быть указано deltaG. Атрибуция: Марк Т. Фаччиотти (собственная работа)
Активный сайт фермента и специфичность субстрата
Химические реагенты, с которыми связывается фермент, представляют собой субстраты фермента . В зависимости от конкретной химической реакции может быть один или несколько субстратов. В некоторых реакциях субстрат с одним реагентом распадается на несколько продуктов.В других случаях два субстрата могут объединиться, чтобы создать одну большую молекулу. Два реагента также могут вступить в реакцию, оба станут модифицированными и покинут реакцию в виде двух продуктов. Место внутри фермента, где связывается субстрат, называется активным сайтом фермента . Активный сайт — это то место, где, так сказать, происходит «действие». Поскольку ферменты являются белками, в активном центре существует уникальная комбинация аминокислотных остатков (также называемых боковыми цепями или R-группами). Каждая боковая цепь аминокислоты характеризуется разными свойствами.Аминокислоты могут быть классифицированы как большие или малые, слабокислые или основные, гидрофильные или гидрофобные, положительно или отрицательно заряженные или нейтральные. Уникальное сочетание аминокислот, их положений, последовательностей, структур и свойств создает очень специфическую химическую среду в активном центре. Эта специфическая среда подходит для связывания, хотя и на короткое время, с определенным химическим субстратом (или субстратами). Благодаря этому подобию головоломки между ферментом и его субстратами (которое адаптируется, чтобы найти наилучшее соответствие между переходным состоянием и активным центром), ферменты известны своей специфичностью.«Наилучшее соответствие» между ферментом и его субстратами обусловлено их соответствующими формами и химической комплементарностью функциональных групп каждого связывающего партнера.
Каждая боковая цепь аминокислоты характеризуется разными свойствами.Аминокислоты могут быть классифицированы как большие или малые, слабокислые или основные, гидрофильные или гидрофобные, положительно или отрицательно заряженные или нейтральные. Уникальное сочетание аминокислот, их положений, последовательностей, структур и свойств создает очень специфическую химическую среду в активном центре. Эта специфическая среда подходит для связывания, хотя и на короткое время, с определенным химическим субстратом (или субстратами). Благодаря этому подобию головоломки между ферментом и его субстратами (которое адаптируется, чтобы найти наилучшее соответствие между переходным состоянием и активным центром), ферменты известны своей специфичностью.«Наилучшее соответствие» между ферментом и его субстратами обусловлено их соответствующими формами и химической комплементарностью функциональных групп каждого связывающего партнера.
Рисунок 2: Это фермент с двумя разными субстратами, связанными в активном сайте. Ферменты представлены в виде капель, за исключением активного сайта, который показывает три R-группы каждой из трех аминокислот, расположенных в активном сайте. Эти группы R взаимодействуют с субстратами посредством водородных связей (представлены пунктирными линиями)
Ферменты представлены в виде капель, за исключением активного сайта, который показывает три R-группы каждой из трех аминокислот, расположенных в активном сайте. Эти группы R взаимодействуют с субстратами посредством водородных связей (представлены пунктирными линиями)
На данном этапе занятий вы должны быть знакомы со всеми типами связей, а также с химическими характеристиками всех функциональных групп.Например, группа R R180 в ферменте, изображенном выше, представляет собой аминокислоту аргинин (сокращенно R) и имеет группу R, которая состоит из нескольких функциональных аминогрупп. Аминофункциональные группы содержат атомы азота (N) и водорода (H). Азот более электроотрицателен, чем водород, поэтому ковалентная связь между N-H является полярной ковалентной связью. Атомы водорода в этой связи будут иметь положительный дипольный момент, а атом азота будет иметь отрицательный дипольный момент. Это позволяет аминогруппам образовывать водородные связи с другими полярными соединениями. Подобным образом, карбонильные атомы кислорода основной цепи валина (V) 81 и глицина (G) 121, аминогруппы водорода основной цепи V81, изображены вовлеченными в водородные связи с низкомолекулярным субстратом.
Подобным образом, карбонильные атомы кислорода основной цепи валина (V) 81 и глицина (G) 121, аминогруппы водорода основной цепи V81, изображены вовлеченными в водородные связи с низкомолекулярным субстратом.
Подготовка к тесту
Посмотрите, какие атомы на рисунке выше участвуют в водородных связях между R-группами аминокислот и субстратом. Вам нужно будет определить их самостоятельно, водородные связи могут не быть задействованы для вас во время теста.
Если вы измените pH раствора, в котором находится этот фермент, сможет ли фермент по-прежнему образовывать водородные связи с субстратом?
Какая подложка (левая или правая), по вашему мнению, более стабильна в активном сайте? Зачем? Как?
Рисунок 3: Это активный центр фермента.Отрисовываются только аминокислоты в активном центре. Подложка сидит прямо по центру. Источник: Создано Marc T. Facciotti (оригинальная работа)
Примечание
Подготовьтесь к тесту: Сначала определите тип макромолекулы на рисунке выше. Во-вторых, нарисуйте и отметьте соответствующие взаимодействия между группами R и субстратом. Объясните, как эти взаимодействия могут измениться, если изменится pH раствора.
Во-вторых, нарисуйте и отметьте соответствующие взаимодействия между группами R и субстратом. Объясните, как эти взаимодействия могут измениться, если изменится pH раствора.
Структурная нестабильность ферментов
Тот факт, что активные центры так хорошо подходят для обеспечения определенных условий окружающей среды, также означает, что они подвержены влиянию местной окружающей среды.Верно, что повышение температуры окружающей среды обычно увеличивает скорость реакции, катализируемой ферментами или иначе. Однако повышение или понижение температуры за пределами оптимального диапазона может повлиять на химические связи в активном центре таким образом, что они менее подходят для связывания субстратов. Высокие температуры в конечном итоге приводят к денатурированию ферментов, как и других биологических молекул, что изменяет естественные свойства вещества. Точно так же pH окружающей среды также может влиять на функцию ферментов.Аминокислотные остатки активного центра обладают собственными кислотными или основными свойствами, оптимальными для катализа. Эти остатки чувствительны к изменениям pH, которые могут нарушить способ связывания молекул субстрата. Ферменты лучше всего подходят для работы в определенном диапазоне pH, и, как и в случае с температурой, экстремальные значения pH (кислотные или основные) окружающей среды могут вызвать денатурирование ферментов.
Эти остатки чувствительны к изменениям pH, которые могут нарушить способ связывания молекул субстрата. Ферменты лучше всего подходят для работы в определенном диапазоне pH, и, как и в случае с температурой, экстремальные значения pH (кислотные или основные) окружающей среды могут вызвать денатурирование ферментов.
Рис. 4: Ферменты имеют оптимальный pH. PH, при котором фермент наиболее активен, будет pH, при котором R-группы активного центра протонируются / депротонируются, так что субстрат может войти в активный центр и может начаться начальная стадия реакции.Некоторым ферментам для полной активности требуется очень низкий pH (кислотный). В организме человека эти ферменты, скорее всего, расположены в нижней части желудка или в лизосомах (клеточная органелла, используемая для переваривания крупных соединений внутри клетки). Источник: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibited
Процесс денатурации ферментов обычно начинается с раскручивания третичной структуры за счет дестабилизации связей, удерживающих третичную структуру вместе. Водородные связи, ионные связи и ковалентные связи (дисульфидные мостики и пептидные связи) могут быть разрушены большими изменениями температуры и pH.Используя приведенную ниже диаграмму активности и температуры фермента, составьте энергетический рассказ для красного фермента. Объясните, что может происходить при температуре от 37 ° C до 95 ° C.
Водородные связи, ионные связи и ковалентные связи (дисульфидные мостики и пептидные связи) могут быть разрушены большими изменениями температуры и pH.Используя приведенную ниже диаграмму активности и температуры фермента, составьте энергетический рассказ для красного фермента. Объясните, что может происходить при температуре от 37 ° C до 95 ° C.
Рис. 5: Ферменты имеют оптимальную температуру. Температура, при которой фермент наиболее активен, обычно является температурой, при которой структура фермента стабильна или не нарушается. Некоторым ферментам требуется определенная температура, чтобы оставаться активными и не денатурировать. Источник: http: // acade.brooklyn.cuny.edu/bi…ge/enz_act.htm
Индуцированная адаптация и ферментная функция
В течение многих лет ученые считали, что связывание фермент-субстрат происходит простым «замком и ключом». Эта модель утверждает, что фермент и субстрат идеально сочетаются друг с другом за один мгновенный шаг. Однако текущие исследования подтверждают более точную точку зрения, называемую индуцированной подгонкой . Модель индуцированной подгонки расширяет модель блокировки и ключа, описывая более динамическое взаимодействие между ферментом и субстратом.Когда фермент и субстрат объединяются, их взаимодействие вызывает умеренный сдвиг в структуре фермента, что подтверждает более продуктивное связывание между ферментом и переходным состоянием субстрата. Это энергетически выгодное связывание максимизирует способность фермента катализировать свою реакцию.
Однако текущие исследования подтверждают более точную точку зрения, называемую индуцированной подгонкой . Модель индуцированной подгонки расширяет модель блокировки и ключа, описывая более динамическое взаимодействие между ферментом и субстратом.Когда фермент и субстрат объединяются, их взаимодействие вызывает умеренный сдвиг в структуре фермента, что подтверждает более продуктивное связывание между ферментом и переходным состоянием субстрата. Это энергетически выгодное связывание максимизирует способность фермента катализировать свою реакцию.
Когда фермент связывает свой субстрат, образуется комплекс фермент-субстрат. Этот комплекс снижает энергию активации реакции и способствует ее быстрому развитию одним из многих способов.На базовом уровне ферменты способствуют химическим реакциям, в которых участвует более одного субстрата, за счет объединения субстратов в оптимальной ориентации. Соответствующая область (атомы и связи) одной молекулы противопоставляется соответствующей области другой молекулы, с которой она должна реагировать. Другой способ, которым ферменты способствуют реакции своих субстратов, — это создание энергетически благоприятной среды в активном центре для протекания реакции. Некоторые химические реакции могут лучше всего протекать в слабокислой или неполярной среде.Химические свойства, возникающие из особого расположения аминокислотных остатков в активном центре, создают энергетически благоприятную среду для реакции специфических субстратов фермента.
Другой способ, которым ферменты способствуют реакции своих субстратов, — это создание энергетически благоприятной среды в активном центре для протекания реакции. Некоторые химические реакции могут лучше всего протекать в слабокислой или неполярной среде.Химические свойства, возникающие из особого расположения аминокислотных остатков в активном центре, создают энергетически благоприятную среду для реакции специфических субстратов фермента.
Энергия активации, необходимая для многих реакций, включает энергию, участвующую в незначительном искажении химических связей, чтобы они могли легче реагировать. Ферментативное действие может способствовать этому процессу. Комплекс фермент-субстрат может снизить энергию активации, искажая молекулы субстрата таким образом, чтобы облегчить разрыв связи.Наконец, ферменты также могут снижать энергию активации, принимая участие в самой химической реакции. Аминокислотные остатки могут обеспечивать определенные ионы или химические группы, которые фактически образуют ковалентные связи с молекулами субстрата в качестве необходимой стадии процесса реакции. В этих случаях важно помнить, что фермент всегда возвращается в исходное состояние по завершении реакции. Одним из отличительных свойств ферментов является то, что они в конечном итоге остаются неизменными в результате катализируемых ими реакций.После того, как фермент закончил катализировать реакцию, он высвобождает свой продукт (ы).
В этих случаях важно помнить, что фермент всегда возвращается в исходное состояние по завершении реакции. Одним из отличительных свойств ферментов является то, что они в конечном итоге остаются неизменными в результате катализируемых ими реакций.После того, как фермент закончил катализировать реакцию, он высвобождает свой продукт (ы).
Рисунок 6: Согласно модели индуцированного соответствия, и фермент, и субстрат претерпевают динамические конформационные изменения при связывании. Фермент переводит субстрат в переходное состояние, тем самым увеличивая скорость реакции.
Создание энергетической истории для реакции выше
Используя приведенный выше рисунок, ответьте на вопросы, поставленные в энергетической истории.
1. Что такое реагенты? Какие продукты?
2. Какую работу совершил фермент?
3. В каком состоянии изначально находится энергия? В какое состояние переходит энергия в конечном состоянии? Это все еще может быть непросто, но постарайтесь определить, где находится энергия в начальном и конечном состоянии.
Регулирование ферментов
Зачем нужно регулировать ферменты?
Потребности и условия сотовой связи варьируются от ячейки к ячейке и меняются в отдельных ячейках со временем.Необходимые ферменты и энергетические потребности клеток желудка отличаются от таковых для жировых клеток, клеток кожи, клеток крови и нервных клеток. Кроме того, пищеварительная клетка усерднее обрабатывает и расщепляет питательные вещества в течение времени, которое следует за едой, по сравнению со многими часами после еды. Поскольку эти клеточные потребности и условия меняются, меняются и необходимые количества и функциональность различных ферментов.
Регулирование ферментов молекулами
Ферменты можно регулировать способами, которые либо способствуют, либо снижают их активность.Существует множество различных типов молекул, которые ингибируют или стимулируют функцию ферментов, и для этого существуют различные механизмы. В некоторых случаях ингибирования ферментов, например, молекула ингибитора достаточно похожа на субстрат, чтобы она могла связываться с активным сайтом и просто блокировать связывание субстрата. Когда это происходит, фермент ингибируется посредством конкурентного ингибирования , потому что молекула ингибитора конкурирует с субстратом за связывание активного сайта. С другой стороны, при неконкурентном ингибировании молекула ингибитора связывается с ферментом в месте, отличном от аллостерического сайта, и все же может блокировать связывание субстрата с активным сайтом.
Когда это происходит, фермент ингибируется посредством конкурентного ингибирования , потому что молекула ингибитора конкурирует с субстратом за связывание активного сайта. С другой стороны, при неконкурентном ингибировании молекула ингибитора связывается с ферментом в месте, отличном от аллостерического сайта, и все же может блокировать связывание субстрата с активным сайтом.
Рис. 7: Конкурентное и неконкурентное ингибирование по-разному влияет на скорость реакции. Конкурентные ингибиторы влияют на начальную скорость, но не влияют на максимальную скорость, тогда как неконкурентные ингибиторы влияют на максимальную скорость.
Некоторые молекулы ингибитора связываются с ферментами в том месте, где их связывание вызывает конформационное изменение, которое снижает сродство фермента к его субстрату. Этот тип торможения называется аллостерическим торможением.Большинство аллостерически регулируемых ферментов состоят из более чем одного полипептида, что означает, что они имеют более одной белковой субъединицы. Когда аллостерический ингибитор связывается с ферментом, все активные центры белковых субъединиц слегка изменяются, так что они связывают свои субстраты с меньшей эффективностью. Есть аллостерические активаторы, а также ингибиторы. Аллостерические активаторы связываются с участками фермента, удаленными от активного центра, вызывая конформационное изменение, которое увеличивает сродство активного сайта (ов) фермента к его субстрату (ам).
Когда аллостерический ингибитор связывается с ферментом, все активные центры белковых субъединиц слегка изменяются, так что они связывают свои субстраты с меньшей эффективностью. Есть аллостерические активаторы, а также ингибиторы. Аллостерические активаторы связываются с участками фермента, удаленными от активного центра, вызывая конформационное изменение, которое увеличивает сродство активного сайта (ов) фермента к его субстрату (ам).
Рис. 8: Аллостерические ингибиторы изменяют активный центр фермента, так что связывание субстрата уменьшается или предотвращается. Напротив, аллостерические активаторы модифицируют активный центр фермента так, что сродство к субстрату увеличивается.
Многие ферменты не работают оптимально или даже не работают, если они не связаны с другими специфическими небелковыми вспомогательными молекулами, либо временно через ионные или водородные связи, либо постоянно через более сильные ковалентные связи.Два типа вспомогательных молекул — кофакторы и коферменты. Связывание с этими молекулами способствует оптимальной конформации и функционированию соответствующих ферментов. Кофакторами являются неорганические ионы, такие как железо (Fe2 + ) и магний (Mg 2+ ). Одним из примеров фермента, которому в качестве кофактора требуется ион металла, является фермент, который строит молекулы ДНК, ДНК-полимераза, для функционирования которой требуется связанный ион цинка (Zn 2+ ). Коферменты — это органические вспомогательные молекулы, основная атомная структура которых состоит из углерода и водорода, которые необходимы для действия ферментов.Наиболее распространенные источники коферментов — это диетические витамины. Некоторые витамины являются предшественниками коферментов, а другие действуют непосредственно как коферменты. Витамин C является коферментом множества ферментов, которые участвуют в создании важного компонента соединительной ткани — коллагена. Важным шагом в расщеплении глюкозы для получения энергии является катализ мультиферментным комплексом, называемым пируватдегидрогеназой.
Связывание с этими молекулами способствует оптимальной конформации и функционированию соответствующих ферментов. Кофакторами являются неорганические ионы, такие как железо (Fe2 + ) и магний (Mg 2+ ). Одним из примеров фермента, которому в качестве кофактора требуется ион металла, является фермент, который строит молекулы ДНК, ДНК-полимераза, для функционирования которой требуется связанный ион цинка (Zn 2+ ). Коферменты — это органические вспомогательные молекулы, основная атомная структура которых состоит из углерода и водорода, которые необходимы для действия ферментов.Наиболее распространенные источники коферментов — это диетические витамины. Некоторые витамины являются предшественниками коферментов, а другие действуют непосредственно как коферменты. Витамин C является коферментом множества ферментов, которые участвуют в создании важного компонента соединительной ткани — коллагена. Важным шагом в расщеплении глюкозы для получения энергии является катализ мультиферментным комплексом, называемым пируватдегидрогеназой. Пируватдегидрогеназа — это комплекс из нескольких ферментов, которому фактически требуется один кофактор (ион магния) и пять различных органических коферментов для катализа его конкретной химической реакции.Следовательно, функция ферментов частично регулируется обилием различных кофакторов и коферментов, которые поставляются в основном с пищей большинства организмов.
Пируватдегидрогеназа — это комплекс из нескольких ферментов, которому фактически требуется один кофактор (ион магния) и пять различных органических коферментов для катализа его конкретной химической реакции.Следовательно, функция ферментов частично регулируется обилием различных кофакторов и коферментов, которые поставляются в основном с пищей большинства организмов.
Компартментализация ферментов
В эукариотических клетках молекулы, такие как ферменты, обычно разделены на разные органеллы. Это позволяет установить еще один уровень регуляции активности ферментов. Ферменты, необходимые только для определенных клеточных процессов, могут размещаться отдельно вместе с их субстратами, что позволяет проводить более эффективные химические реакции.Примеры такого рода регуляции ферментов, основанной на местоположении и близости, включают ферменты, участвующие в последних стадиях клеточного дыхания, которые происходят исключительно в митохондриях, и ферменты, участвующие в переваривании клеточного мусора и чужеродных материалов, расположенных в лизосомах.






 Такие препараты отлично помогают поджелудочной железе переваривать любую пищу, поддерживая нужный уровень ферментов и обеспечивают органу покой, поскольку высокая концентрация ферментов в просвете двенадцатиперстной кишки снижает активность поджелудочной.
Такие препараты отлично помогают поджелудочной железе переваривать любую пищу, поддерживая нужный уровень ферментов и обеспечивают органу покой, поскольку высокая концентрация ферментов в просвете двенадцатиперстной кишки снижает активность поджелудочной.