Что такое ферменты и каковы их функции? Действие ферментов и их
Ферменты: общая характеристика, функции, виды и механизмы действия

Различные химические процессы – основа жизнедеятельности любого организма. Главная роль в них отведена ферментам. Ферменты или энзимы являются природными биокатализаторами. В организме человека они принимают активное участие в процессе переваривания пищи, функционировании центральной нервной системы и стимуляции роста новых клеток. По своей природе ферменты относятся к белкам, предназначенным для ускорения различных биохимических реакций в организме. Расщепление белков, жиров, углеводов и минералов – процессы, в которых энзимы выступают одними из основных действующих компонентов.
Существует довольно много разновидностей ферментов, каждая из которых предназначена для воздействия на то или иное вещество. Белковые молекулы уникальны и не способны заменять друг друга. Для их активности необходим определенный температурный диапазон. Для ферментов человека идеальной является нормальная температура тела. Кислород и солнечный свет разрушает ферменты.
Общая характеристика ферментов
Являясь органическими веществами белкового происхождения, ферменты действуют по принципу неорганических катализаторов, ускоряя реакции в клетках, в которых они синтезируются. Синоним к названию таких белковых молекул – энзимы. Почти все реакции в клетках происходят с участием специфических ферментов. В их составе выделяют две части. Первая представляет собой непосредственно белковую часть, представленную белком третичной структуры и именуемую апоферментом, вторая – активный центр энзима, получивший название кофермент. Последний может представлять собой органические/неорганические вещества, и именно он выступает основным «ускорителем» биохимических реакций в клетке. Обе части образуют единую белковую молекулу, названную холоферментом.
Каждый фермент предназначен для воздействия на конкретное вещество, именуемое субстратом. Результат произошедшей реакции называется продуктом. Названия самих ферментов довольно часто образуется на основе названия субстрата с добавлением окончания «-аза». К примеру, энзим, предназначенный для расщепления янтарной кислоты (сукцината), носит название сукцинатдегидрогеназа. Кроме того, название белковой молекулы определяется и типом реакции, выполнение которой она обеспечивает. Так, дегидрогеназы отвечают за процесс регенерации и окисления, а гидролазы – за расщепление химической связи.
Действие ферментов различных видов направлено на определенные субстраты. То есть участие белковых молекул в тех или иных биохимических реакциях индивидуально. Каждый фермент связан со своим субстратом и может работать только с ним. За неразрывность этой связи отвечает апофермент.
Ферменты могут пребывать в свободном состоянии в цитоплазме клетки или же взаимодействовать с более сложными структурами. Также существуют определенные их виды, действующие вне клетки. К ним относятся, например, ферменты, расщепляющие белки и крахмал. Кроме того, энзимы могут вырабатываться различными микроорганизмами.
Современная энзимология

Для изучения ферментов и процессов, происходящих с их участием, предназначена отдельная область биохимической науки – энзимология. Впервые информация об особых белковых молекулах, действующих по принципу катализаторов, появилась в результате изучения пищеварительных процессов и реакций брожения, происходящих в организме человека. Существенный вклад в развитие современной энзимологии приписывается Л. Пастеру, который считал, что все биохимические реакции в организме происходят при участии исключительно живых клеток. О неживых «участниках» таких реакций впервые было заявлено Э. Бухнером в начале ХХ ст. В то время исследователю удалось определить, что катализатором в процессе сбраживания сахарозы с последующим выделением этилового спирта и диоксида углерода выступает бесклеточный дрожжевой экстракт. Данное открытие стало решительным толчком для подробного изучения так называемых катализаторов различных биохимических процессов в организме.
Уже в 1926 году был выделен первый фермент – уреаза. Автором открытия стал Дж. Самнер, сотрудник Корнеллского университета. После этого в течение одного десятилетия учеными был выделен ряд других энзимов, а белковая природа всех органических катализаторов – доказана окончательно. На сегодняшний день миру известно свыше 700 различных ферментов. Но при этом современная энзимология продолжает активное изучение, выделение и изучение свойств отдельных видов белковых молекул.
Ферменты: белковая природа
Так же как и белки, ферменты принято делить на простые и сложные. Первые представляют собой соединения, состоящие из аминокислот, например, трипсина, пепсина или лизоцима. Сложные энзимы, как упоминалось выше, состоят из белковой части с аминокислотами (апофермента) и небелковой составляющей, получившей названием кофактора. Только сложные ферменты могут участвовать в биореакциях. Кроме того, подобно белкам ферменты бывают моно- и полимерами, то есть состоят из одной или нескольких субъединиц.
Общими свойствами ферментов как белковых структур являются:
- эффективность действия, подразумевающая значительное ускорение химических реакций в организме;
- избирательность к субстрату и типу выполняемой реакции;
- чувствительность к показателям температуры, кислотно-щелочного баланса и другим неспецифическим физико-химическим факторам среды, в которой действуют ферменты;
- чувствительность к действию химических реагентов и др.
Функции ферментов

Основная роль ферментов в организме человека – преобразование одних веществ в другие, то есть субстратов в продукты. Они выступают катализаторами свыше чем в 4 тысячах биохимических жизненно важных реакций. Функции ферментов заключаются в направлении и регуляции метаболических процессов. Как неорганические катализаторы, энзимы могут в разы ускорять прямую и обратную биореакцию. Стоит отметить, что при их действии химическое равновесие не нарушается. Происходящие реакции обеспечивают распад и окисление питательных веществ, попадающих в клетки. Каждая белковая молекула может выполнять огромное множество действий в минуту. При этом белок ферментов, вступая в реакцию с различными веществами, остается неизменным. Энергия, вырабатываемая в процессе окисления питательных веществ, используется клеткой так же, как и продукты расщепления веществ, необходимые для синтеза органических соединений.
Сегодня широкое применение нашли не только ферменты-препараты медицинского назначения. Энзимы также используются в пищевой и текстильной промышленности, в современной фармакологии.
Классификация ферментов
На собрании V Международного биохимического союза, прошедшем в Москве в 1961 году, была принята современная классификация ферментов. Данная классификация подразумевает их деление на классы, в зависимости от типа реакции, в которой энзим выступает катализатором. Кроме того, каждый класс ферментов делится на подклассы. Для их обозначения используется код из четырех чисел, разделенных точками:
- первое число обозначает механизм реакции, в которой фермент выступает катализатором;
- второе число указывает на подкласс, к которому принадлежит данный энзим;
- третье число – подкласс описываемого фермента;
- и четвертое – порядковый номер энзима в подклассе, к которому он принадлежит.
Всего в современной классификации ферментов выделяют шесть их классов, а именно:
- Оксидоредуктазы – энзимы, выступающие катализаторами в различных окислительно-восстановительных реакциях, происходящих в клетках. В данный класс входит 22 подкласса.
- Трансферазы – класс ферментов с 9 подклассами. В него входят энзимы, обеспечивающие реакции транспорта между разными субстратами, ферменты, принимающие участие в реакциях взаимопревращения веществ, а также обезвреживания различных органических соединений.
- Гидролазы – энзимы, разрывающие внутримолекулярные связи субстрата посредством присоединения к нему молекул воды. В данном классе насчитывается 13 подклассов.
- Лиазы – класс, в составе которого находятся только сложные ферменты. В нем насчитывается семь подклассов. Энзимы, относящиеся к данному классу, выступают катализаторами в реакциях разрыва С-О, С-С, С-N и прочих типов органических связей. Также ферменты класса лиазы участвуют в обратимых биохимических реакциях отщепления негидролитическим путем.
- Изомеразы – энзимы, выступающие катализаторами в химических процессах изомерных превращений, происходящих в одной молекуле. Как и к предыдущему классу к ним относятся только сложные ферменты.
- Лигазы, иначе именуемые синтетазами – класс, включающий шесть подклассов и представляющий энзимы, катализирующие процесс соединения двух молекул под воздействием АТФ.
Состав ферментов

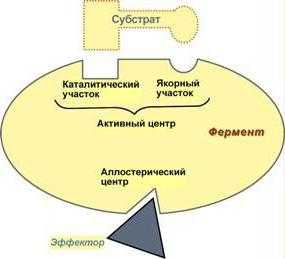
Состав ферментов объединяет в себе отдельные области, отвечающие за выполнение конкретных функций. Так, в составе ферментов, как правило, выделяют активный и аллостерический центры. Последний, к слову, есть далеко не у всех белковых молекул. Активный центр представляет собой сочетание остатков аминокислот, отвечает за контакт с субстратом и выполнение катализа. Активный центр в свою очередь делится на две части: якорную и каталитическую. Энзимы, состоящие их нескольких мономеров, могут содержать более одного активного центра.
Аллостерический центр отвечает за активность ферментов. Свое название такая часть ферментов получила из-за того что его пространственная конфигурация не имеет ничего общего с молекулой субстрата. Изменение скорости реакции, происходящей с участием фермента, обуславливается связыванием различных молекул именно с аллостерическим центром. Энзимы, содержащие в своем составе аллостерические центры, являются полимерными белками.
Механизм действия ферментов
Действие ферментов можно разделить на несколько этапов, в частности:
- первый этап подразумевает присоединение субстрата к энзиму, вследствие чего формируется фермент-субстратный комплекс;
- второй этап заключается в преобразовании полученного комплекса в один или сразу несколько переходных комплексов;
- третий этап – образование комплекса фермент-продукт;
- и, наконец, четвертый этап подразумевает разделение конечного продукта реакции и фермента, остающегося в неизменном виде.
Кроме того, действие ферментов может происходить с участием различных механизмов катализа. Так, выделяют кислотно-основной и ковалентный катализ. В первом случае в реакции участвуют энзимы, содержащие в своем активном центре специфические остатки аминокислот. Такие группы ферментов являются отличными катализаторами многочисленных реакций в организме. Ковалентный катализ подразумевает действие ферментов, которые при контакте с субстратами формируют нестабильные комплексы. Результатом таких реакций является образование продуктов посредством внутримолекулярных перестроек.
Также выделяют три основных типа ферментативных реакций:
- «Пинг-понг» – реакция, при которой энзим соединяется с одним субстратом, заимствуя у него определенные вещества, а потом взаимодействует с другим субстратом, отдавая ему полученные химические группы.
- Последовательные реакции подразумевают поочередное присоединение к ферменту сначала одного, а потом и другого субстрата, в результате чего формируется так называемый «тройной комплекс», в котором и происходит катализ.
- Случайные взаимодействия – реакции, при которых субстраты взаимодействуют с ферментом неупорядоченно, а после катализа в таком же порядке и отщепляются.
Регуляция активности ферментов

Активность ферментов является непостоянной и во многом зависит от различных факторов среды, в которой им приходится действовать. Так основным показателями для активности ферментов являются факторы внутреннего и внешнего воздействия на клетку. Активность ферментов изменяют в каталах, показывающих количество энзима, превращающего за секунду 1 моль субстрата, с которым он взаимодействует. Международная единица измерения – Е, демонстрирующая количество энзима, способного за 1 минуту преобразовать 1 мкмоль субстрата.
Ингибирование ферментов: процесс
Одним из основных направлений в современной медицине и энзимологии в частности является разработка методов управления скоростью метаболических реакций, происходящих с участием энзимов. Ингибированием принято называть уменьшение активности ферментов посредством использования различных соединений. Соответственно, вещество, обеспечивающее специфичное снижение активности белковых молекул, получило название ингибитора. Существует различные виды ингибирования. Так, в зависимости от прочности связывания энзима с ингибитором процесс их взаимодействия может быть обратимым и, соответственно, необратимым. А в зависимости от того, как воздействует ингибитор на активный центр энзима, процесс ингибирования может быть конкурентным и неконкурентным.
Активирование ферментов в организме
В отличие от ингибирования, активация ферментов подразумевает увеличение их действия в происходящих реакциях. Вещества, позволяющие получить необходимый результат, называются активаторами. Такие вещества могут иметь органическую и неорганическую природу. Например, органическими активаторами могут выступать желчные кислоты, глутатион, энтерокиназа, витамин С, разные тканевые ферменты и др. В качестве неорганических активаторов могут использоваться пепсиноген и ионы различных металлов, чаще всего двухвалентных.
Роль ферментов и практическое использование
Различные ферменты, реакции, происходящие с их участием, а также их результат нашли свое широкое применения в многообразных сферах. На протяжении многих лет действие ферментов активно используется в пищевой, кожевенной, текстильной, фармацевтической и многих других промышленных отраслях. Например, с помощью природных энзимов исследователи пытаются повысить эффективность спиртового брожения при изготовлении алкогольных напитков, улучшить качество продуктов питания, разработать новые методы похудения и др. Но стоит отметить, что использование ферментов в различных отраслях промышленности по сравнению с применением химических катализаторов значительно проигрывает. Ведь основная сложность воплощения такой задачи на практике является термическая неустойчивость энзимов и их повышенная чувствительность к воздействию различных факторов. Также невозможно многократное использование ферментов в производстве из-за сложности их отделения от готовых продуктов выполненных реакций.
Кроме того, свое активное применение действие ферментов обрело в медицине, сельскохозяйственной и химической отрасли. Рассмотрим подробнее, как и где может использоваться действие ферментов:
-
Пищевая промышленность. Всем известно, что хорошее тесто при выпекании должно подняться и разбухнуть. Но далеко не все понимают, как именно это происходит. В муке, из которой и готовится тесто, имеется множество различных ферментов. Так, амилаза в составе муки участвует в процессе разложения крахмала, при котором активно выделяется углекислый газ, способствующий так называемому «разбуханию» теста. Клейкость теста и удерживание в нем СО2 обеспечивается за счет действия фермента под названием протеаза, который также содержится в муке. Получается, что такие, казалось бы. простые вещи, как приготовление теста для выпечки, подразумевают под собой сложнейшие химические процессы. Также особую востребованность некоторые ферменты, реакции, происходящие с их участием, обрели в области производства алкоголя. Различные энзимы используются в составе дрожжей, обеспечивающих качество процесса брожения спирта. Кроме того, некоторые ферменты (например, папаин или пепсин) помогают растворять осадок в спиртосодержащих напитках. Также активно применяются ферменты в производстве кисломолочных продуктов и сыра в том числе.
-
В кожевенной отрасли ферменты используются для эффективного расщепления белков, что наиболее актуально при выведении стойких пятен от различных продуктов питания, крови и др.
-
В производстве стиральных порошков может использоваться целлюлаза. Но при использовании таких порошков для получения заявленного результата необходимо соблюдать допустимый температурный режим стирки.
Кроме того, в производстве кормовых добавок ферменты используются с целью увеличения их питательной ценности, гидролиза белков и некрахмальных полисахаридов. В текстильной промышленности ферменты позволяют изменять свойства поверхности текстильных изделий, а в целлюлозно-бумажной промышленности – удалять чернила и тонеры в процессе вторичной переработки бумаги.
Огромная роль ферментов в жизни современного человека неоспорима. Уже сегодня их свойства активно используются различными сферами, но также непрерывно ведутся поиски новых вариантов применения уникальных свойств и функций ферментов.
Ферменты человека и наследственные заболевания
Многие заболевания развиваются на фоне энзимопатий – нарушений функций ферментов. Выделяют первичные и вторичные энзимопатии. Первичные нарушения являются наследственными, вторичные – приобретенными. Наследственные энзимопатии относят, как правило, к метаболическим заболеваниям. Наследование генетических дефектов или снижения активности ферментов происходит преимущественно по аутосомно-рецессивному типу. К примеру, такое заболевание как фенилкетонурия является следствием дефекта такого фермента как фенилаланин-4-монооксигеназа. Данный фермент в норме отвечает за преобразование фенилаланина в тирозин. В результате нарушений функций фермента происходит накопление аномальных метаболитов фенилаланина, являющихся токсичными для организма.
Также к энзимопатиям относят подагру, развитие которой вызвано нарушением обмена пуриновых оснований и как следствие стабильным увеличением уровня мочевой кислоты в крови. Галактоземия – еще одно заболевание, вызванное наследственным нарушением функциональности ферментов. Развивается данная патология из-за нарушения углеводного обмена, при котором организм не может преобразовывать галактозу в глюкозу. Следствием такого нарушения является накопление галактозы и ее метаболических продуктов в клетках, что приводит к поражениям печени, ЦНС и других жизненно важных систем организма. Основными проявлениями галактоземии выступают диарея, рвота, появляющиеся сразу после рождения ребенка, механическая желтуха, катаракта, задержка физического и интеллектуального развития.
Разные гликогенозы и липидозы также относятся к наследственным энзимопатиям, иначе именуемым энзимопатологиями. Развитие таких нарушений обусловлено низкой ферментной активностью в организме человека или полным ее отсутствием. Наследственные метаболические дефекты, как правило, сопровождаются развитием заболеваний с различной степенью тяжести. При этом некоторые энзимопатии могут протекать бессимптомно и определяются лишь при проведении соответствующих диагностических процедур. Но в основном первые симптомы наследственных метаболических нарушений проявляются уже в раннем детстве. Реже это происходит у старших детей и тем более у взрослых.
При диагностике наследственных энзимопатий немаловажную роль играет генеалогический метод исследования. При этом реакции ферментов специалисты проверяют лабораторным путем. Наследственные ферментопатии могут приводить к нарушениям выработки гормонов, характеризующихся особым значением для полноценной жизнедеятельности организма. Например, корой надпочечников вырабатываются глюкокортикоиды, отвечающие за регуляцию обмена углеводов, минералокортикоиды, участвующие в водно-солевом обмене, а также андрогенные гормоны, оказывающие непосредственное влияние на развитие вторичных половых признаков у подростков. Таким образом, нарушение выработки перечисленных гормонов может привести к развитию многочисленных патологий со стороны различных систем органов.
Пищеварительные ферменты
Процесс переработки пищи в организме человека происходит с участием различных пищеварительных ферментов. В процессе переваривания пищи все вещества расщепляются до небольших молекул, ведь исключительно низкомолекулярные соединения способны проникать сквозь стенку кишечника и всасываться в кровоток. Особая роль в данном процессе отводится ферментам, расщепляющим белки до аминокислот, жиров до глицерина и жирных кислот, а крахмала до сахаров. Расщепление белков обеспечивается действием фермента пепсина, содержащегося в основном органе пищеварительной системы – желудке. Часть пищеварительных ферментов вырабатывается в кишечник поджелудочной железой. В частности к ним относится:
- трипсин и химотрипсин, основным предназначением которых выступает гидролиз белков;
- амилаза – ферменты, расщепляющие жиры;
- липаза – пищеварительные ферменты, расщепляющие крахмал.
Такие пищеварительные энзимы, как трипсин, пепсин, химотрипсин вырабатываются в форме проферментов, и только после их попадания в желудок и кишечник они становятся активными. Подобная особенность защищает ткани желудка и поджелудочной железы от агрессивного их воздействия. Кроме того, внутренняя оболочка этих органов дополнительно покрыта слоем слизи, что обеспечивает еще большую их безопасность.
Часть пищеварительных ферментов вырабатывается также в тонком кишечнике. За переработку целлюлозы, поступающей в организм вместе с растительной пищей, отвечает фермент с созвучным названием целлюлаза. Другими словами, практически в каждом отделе желудочно-кишечного тракта вырабатываются пищеварительные ферменты, начиная со слюнных желез и заканчивая толстой кишкой. Каждый вид энзимов выполняет свои функции, в совокупности обеспечивая качественное переваривание пищи и полноценное всасывание всех полезных веществ в организме.
Ферменты поджелудочной железы
Поджелудочная железа является органом смешанной секреции, то есть выполняет и эндо- и экзогенные функции. Поджелудочная железа, как упоминалось выше, вырабатывает ряд ферментов, которые активируются под воздействием желчи, поступающей вместе с энзимами в органы пищеварения. Ферменты поджелудочной железы отвечают за расщепление жиров, белков и углеводов на простые молекулы, способные проникать сквозь клеточную мембрану в кровоток. Таким образом, благодаря ферментам поджелудочной железы происходит полное усвоение полезных веществ, поступающих в организм вместе с пищей. Рассмотрим подробнее действие энзимов, синтезируемых клетками данного органа ЖКТ:
- амилаза вместе с такими энзимами тонкого кишечника, как мальтаза, инвертаза и лактаза обеспечивают процесс расщепления сложных углеводов;
- протеазы, иначе именуемые протеолитическими ферментами в организме человека, представлены трипсином, карбоксипептидазой и эластазой и отвечают за расщепление белков;
- нуклеазы – ферменты поджелудочной железы, представленные дезоксирибонуклеазой и рибонуклеазой, воздействующими на аминокислоты РНК, ДНК;
- липаза – фермент поджелудочной железы, отвечающий за преобразование жиров в жирные кислоты.
Также поджелудочной железой синтезируется фосфолипаза, эстераза и щелочная фасфтаза.
Наиболее опасными в активном виде являются протеолитические ферменты, вырабатываемые органом. Если процесс их выработки и выделения в другие органы пищеварительной системы нарушается, энзимы активируются непосредственно в поджелудочной железе, что приводит к развитию острого панкреатита и сопутствующих тому осложнений. Ингибиторами протеолитических энзимов, позволяющими затормозить их действие, являются панкреатический полипептид и глюкагон, соматостатин, пептид YY, энкефалин и панкреастатин. Перечисленные ингибиторы способны затормозить выработку панкреатических энзимов путем воздействия на активные элементы пищеварительной системы.
Ферменты тонкой кишки
В тонкой кишке происходят основные процессы переваривания поступающей в организм пищи. В данном отделе ЖКТ также синтезируются ферменты, процесс активации которых происходит совместно с энзимами поджелудочной железы и желчного пузыря. Тонкая кишка – отдел пищеварительного тракта, в котором происходят завершающие этапы гидролиза питательных веществ, поступающих в организм вместе с продуктами питания. В нем синтезируются различные ферменты, расщепляющие олиго- и полимеры на мономеры, которые без проблем могут всасываться слизистой тонкой кишки и поступать в лимфо- и кровоток.
Под воздействием энзимов тонкой кишки происходит процесс расщепления белков, прошедших предварительное преобразование в желудке, на аминокислоты, сложных углеводов на моносахариды, жиров – на жирные кислоты и глицерин. В составе кишечного сока насчитывается свыше 20 видов ферментов, участвующих в процессе переваривания пищи. С участием панкреатических и кишечных ферментов обеспечивается полная отработка химуса (частично переваренной пищи). Все процессы в тонком кишечнике происходят в течение 4 часов после поступления химуса в данный отдел пищеварительного тракта.
Важную роль в переваривании пищи в тонкой кишке играет желчь, поступающая в двенадцатиперстную кишку в процессе пищеварения. В составе самой желчи ферменты отсутствуют, но при этом данная биологическая жидкость усиливает действие энзимов. Наиболее значимой желчь оказывается для расщепления жиров, превращая их в эмульсию. Такой эмульгированный жир намного быстрее расщепляется под воздействием ферментов. Жирные кислоты, взаимодействуя с желчными кислотами, преобразуются в легкорастворимые соединения. Кроме того, выделение желчи стимулирует перистальтику кишечника и выработку пищеварительного сока поджелудочной железой.
Кишечный сок синтезируется железами, расположенными в слизистой тонкой кишки. В составе такой жидкости и присутствуют пищеварительные ферменты, а также энтерокиназа, предназначенная для активации действия трипсина. Кроме того, в кишечном соке имеется фермент под названием эрепсин, необходимый для завершающего этапа расщепления белков, энзимы, действующие на различные виды углеводов (например, амилаза и лактаза), а также липаза, предназначенная для преобразования жиров.
Желудочные ферменты
Процесс переваривания пищи поэтапно происходит в каждом отделе желудочно-кишечного тракта. Так, начинается он еще в ротовой полости, где пища измельчается зубами и смешивается со слюной. Именно в слюне содержатся ферменты, расщепляющие сахар и крахмал. После ротовой полости измельченная пища поступает по пищеводу в желудок, где и начинается следующий этап ее переваривания. Основным желудочным ферментом является пепсин, предназначенный для преобразования белков в пептиды. Также в желудке присутствует желатиназа – фермент, процесс расщепления коллагена и желатина для которого выступает основной задачей. Плюс ко всему пища в полости данного органа подвергается действию амилазы и липазы, соответственно, расщепляющие крахмал и жиры.
От качества пищеварительного процесса зависит возможность получения организмом всех необходимых питательных элементов. Расщепление сложных молекул на множество простых обеспечивает их дальнейшее всасывание в крово- и лимфоток на последующих этапах пищеварения в других отделах ЖКТ. Недостаточная выработка желудочных ферментов может стать причиной развития различных заболеваний.
Ферменты печени

Огромным значением для протекания различных биохимических процессов в организме обладают ферменты печени. Функции белковых молекул, вырабатываемых данным органом, настолько многочисленны и многообразны, что все ферменты печени принято делить на три основные группы:
- Секреторные энзимы, предназначенные для регуляции процесса свертывания крови. К ним относятся холинэстераза и протромбиназа.
- Индикаторные ферменты печени, включающие аспартатаминотрансферазу, обозначаемую аббревиатурой АСТ, аланинаминотрасферазу с соответственным обозначением АЛТ и лактатдегидрогеназу – ЛДГ. Перечисленные энзимы сигнализируют о поражениях тканей органа, при которых разрушаются гепатоциты, «выходят» из клеток печени и поступают в кровоток;
- Экскреторные энзимы вырабатываются печенью и покидают пределы органа с потом желчи. К таким энзимам относится щелочная фосфатаза. При нарушениях оттока желчи из органа уровень щелочной фосфатазы растет.
Нарушение работы тех или иных ферментов печени в будущем может привести к развитию различных заболеваний или сигнализировать об их наличии в настоящее время.
Одним из самых информативных анализов при болезнях печени является биохимия крови, позволяющая определить уровень индикаторных ферментов АСТ, АТЛ. Так, нормальными показателями аспартатаминотрансферазы для женщины является 20-40 Ед/л, а для представителей сильного пола – 15-31 Ед/л. Повышение активности данного фермента может указывать на повреждение гепатоцитов механической или некротической природы. Содержание аланинаминотрасферазы в норме не должно превышать у женщин отметки в 12-32 Ед/л, а для мужчин нормальным считается показатель активности АЛТ в пределах 10-40 Ед/л. Увеличение активности АЛТ, достигаемое десятикратных показателей, может свидетельствовать о развитии инфекционных заболеваний органа, причем еще задолго до появления их первых симптомов.
Дополнительные исследования активности ферментов печени используются, как правило, для дифференциальной диагностики. Для этого может проводиться анализ на ЛДГ, ГГТ и ГлДГ:
-
Нормой активности лактатдегидрогеназы является показатель, колеблющийся в пределах 140-350 Ед/л.
-
Повышенные показатели ГлДГ могут являться признаком дистрофических поражений органа, тяжелых интоксикаций, заболеваний инфекционной природы или онкологии. Максимально допустимым показателем такого фермента для представительниц женского пола является 3,0 Ед/л, а для мужчин – 4, 0 Ед/л.
-
Нормой активности фермента ГГТ для мужчин является показатель до 55 Ед/л, для женщин – до 38 Ед/л. Отклонения от указанной нормы могут свидетельствовать о развитии диабета, а также болезней желчевыводящих путей. В таком случае показатель активности фермента может увеличиваться в десятки раз. Кроме того, ГГТ в современной медицине применяется для определения алкогольных гепатозов.
Ферменты, синтезируемые печенью, обладают различными функциями. Так, часть из них вместе с желчью выводится из органа через желчные протоки и принимает активное участие в процессе переваривания пищи. Ярким примером того выступает щелочная фосфатаза. Нормальный показатель активности данного фермента в крови должен находиться в пределах 30-90 Ед/л. Стоит отметить, что у представителей мужского пола такой показатель может достигать 120 Ед/л (при интенсивных обменных процессах цифра может возрастать).
Ферменты крови
Определение активности ферментов и их содержания в организме является одним из основных диагностических методов при определении различных заболеваний. Так, ферменты крови, содержащиеся в ее плазме, могут указывать на развитие патологий печени, воспалительных и некротических процессов в клетках тканей, болезней сердечно-сосудистой системы и др. Ферменты крови принято делить две группы. В первую группу входят энзимы, выделяемые в плазму крови некоторыми органами. К примеру, печенью вырабатываются так называемые предшественники энзимов, необходимых для работы свертывающей системы крови.
Вторая группа насчитывает гораздо большее количество ферментов крови. В организме здорового человека такие белковые молекулы физиологическим значением в плазме крови не обладают, поскольку действуют исключительно на внутриклеточном уровне в органах и тканях, которыми вырабатываются. В норме активность таких ферментов должна быть низкой и постоянной. При повреждении клеток, которым сопровождаются различные заболевания, ферменты, содержащиеся в них, высвобождаются и поступают в кровоток. Причиной тому могут являться воспалительные и некротические процессы. В первом случае высвобождение ферментов происходит из-за нарушения проницаемости клеточной мембраны, во втором – ввиду нарушения целостности клеток. При этом, чем выше уровень содержания ферментов в крови, тем больше степень поражения клеток.
Биохимический анализ позволяет определить активность тех или иных энзимов в плазме крови. Он активно применяется при диагностике различных заболеваний печени, сердца, скелетной мускулатуры и иных видов тканей в человеческом организме. Кроме того, так называемая энзимодиагностика при определении некоторых заболеваний учитывает субклеточную локализацию ферментов. Результаты таких исследований позволяют определить, какие именно процессы происходят в организме. Так, при воспалительных процессах в тканях ферменты крови имеют цитозольную локализацию, а при некротических поражениях определяется наличие ядерных или митохондриальных энзимов.
Стоит отметить, что далеко не всегда увеличение содержания ферментов в крови обусловлено тканевыми повреждениями. Активное патологическое разрастание тканей в организме, в частности при онкозаболеваниях, повышенная выработка определенных ферментов или же нарушение выводящей способности почек также могут определяться повышенным содержанием некоторых энзимов в крови.
Ферменты: препараты для медицинского применения

В современной медицине особое место отводится использованию различных ферментов в диагностических и терапевтических целях. Также энзимы нашли свое применение в качестве специфических реактивов, позволяющих с точностью определять разные вещества. Например, выполняя анализ на определение уровня глюкозы в моче и сыворотке крови, в современных лабораториях используется глюкозооксидаза. Уреаза применяется для оценки количественного содержания мочевины в анализах мочи и крови. Разные виды дегидрогеназ позволяют с точностью определять наличие различных субстратов (лактат, пируват, этиловый спирт и т.д.).
Высокая иммуногенность ферментов значительно ограничивает их использование в терапевтических целях. Но, несмотря на это, так называемая энзимотерапия активно развивается, используя ферменты (препараты с их содержанием), как средство заместительной терапии или элемент комплексного лечения. Заместительная терапия применяется при заболеваниях ЖКТ, развитие которых вызвано недостаточной выработкой пищеварительного сока. При дефиците панкреатических энзимов их недостаток может компенсироваться посредством перорального приема лекарственных препаратов, в составе которых они присутствуют.
В роли дополнительного элемента в комплексном лечении ферменты могут использоваться при различных заболеваниях. Например, такие протеолитические энзимы, как трипсин и химотрипсин применяются при обработке гнойных ран. Препараты с ферментами дезоксирибонуклеазой и рибонуклеазой используются при лечении аденовирусных конъюнктивитов или герпетических кератитов. Ферментные препараты также применяются при лечении тромбозов и тромбоэмболий, онкологических заболеваний и др. Их использование актуально для рассасывания контрактур ожоговых и послеоперационных рубцов.
Применение ферментов в современной медицине весьма многообразно и данное направление постоянно развивается, что позволяет постоянно находить новые и более эффективные методы лечения тех или иных заболеваний.
medaboutme.ru
что это такое, зачем нужны, принцип действия
- Общие свойства ферментов
- Классификация
- Пищеварительные ферменты
- Роль заместительной терапии препаратом «Микразим»
Жизнь любого организма возможна благодаря протекающим в нем процессам обмена веществ. Этими реакциями управляют природные катализаторы, или ферменты. Другое название этих веществ – энзимы. Термин «ферменты» происходит от латинского fermentum, что означает «закваска». Понятие появилось исторически при изучении процессов брожения.

Рис. 1 — Брожение с использованием дрожжей – типичный пример ферментативной реакции
Человечество давно пользуется полезными свойствами этих ферментов. Например, уже много веков из молока с помощью сычужного фермента делают сыр.
Ферменты отличаются от катализаторов тем, что действуют в живом организме, тогда как катализаторы – в неживой природе. Отрасль биохимии, которая изучает эти важнейшие для жизни вещества, называется энзимологией.
Общие свойства ферментов
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию. Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры.
Основные свойства ферментов:
- специфичность: способность фермента действовать только на специфический субстрат, например, липазы – на жиры;
- каталитическая эффективность: способность ферментативных белков ускорять биологические реакции в сотни и тысячи раз;
- способность к регуляции: в каждой клетке выработка и активность ферментов определяется своеобразной цепью превращений, влияющей на способность этих белков вновь синтезироваться.
Роль ферментов в организме человека невозможно переоценить. В то время, когда еще только открыли структуру ДНК, говорили, что один ген отвечает за синтез одного белка, который уже определяет какой-то определенный признак. Сейчас это утверждение звучит так: «Один ген – один фермент – один признак». То есть без активности ферментов в клетке жизнь не может существовать.
Классификация
В зависимости от роли в химических реакциях, различаются такие классы ферментов:
|
Классы |
Особенности |
|
Оксиредуктазы |
Катализируют окисление своих субстратов, перенося электроны или атомы водорода |
|
Трансферазы |
Участвуют в переносе химических групп из одного вещества в другое |
|
Гидролазы |
Расщепляют крупные молекулы на более мелкие, добавляя к ним молекулы воды |
|
Лиазы |
Катализируют расщепление молекулярных связей без процесса гидролиза |
|
Изомеразы |
Активируют перестановку атомов в молекуле |
|
Лигазы (синтетазы) |
Образуют связи с атомами углерода, используя энергию АТФ. |
В живом организме все ферменты делятся на внутри- и внеклеточные. К внутриклеточным относятся, например, ферменты печени, участвующие в реакциях обезвреживания различных веществ, поступающих с кровью. Они обнаруживаются в крови при повреждении органа, что помогает в диагностике его заболеваний.
Внутриклеточные ферменты, которые являются маркерами повреждения внутренних органов:
- печень – аланинаминотрансефраза, аспартатаминотрансфераза, гамма-глютамилтранспептидаза, сорбитдегидрогеназа;
- почки – щелочная фосфатаза;
- предстательная железа – кислая фосфатаза;
- сердечная мышца – лактатдегидрогеназа
Внеклеточные ферменты выделяются железами во внешнюю среду. Основные из них секретируются клетками слюнных желез, желудочной стенки, поджелудочной железы, кишечника и активно участвуют в пищеварении.
Пищеварительные ферменты
Пищеварительные ферменты – это белки, которые ускоряют расщепление крупных молекул, входящих в состав пищи. Они разделяют такие молекулы на более мелкие фрагменты, которые легче усваиваются клетками. Основные типы пищеварительных ферментов – протеазы, липазы, амилазы.
Основная пищеварительная железа – поджелудочная. Она вырабатывает большинство этих ферментов, а также нуклеаз, расщепляющих ДНК и РНК, и пептидаз, участвующих в образовании свободных аминокислот. Причем незначительное количество образующихся ферментов способно «обработать» большой объем пищи.
При ферментативном расщеплении питательных веществ выделяется энергия, которая расходуется для процессов обмена веществ и жизнедеятельности. Без участия ферментов, подобные процессы происходили бы слишком медленно, не обеспечивая организм достаточным энергетическим запасом.
Кроме того, участие ферментов в процессе пищеварения обеспечивает распад питательных веществ до молекул, способных проходить через клетки кишечной стенки и поступать в кровь.
Амилаза
Амилаза вырабатывается слюнными железами. Она действует на крахмал пищи, состоящий из длинной цепи молекул глюкозы. В результате действия этого фермента образуются участки, состоящие из двух соединенных молекул глюкозы, то есть фруктоза, и другие короткоцепочечные углеводы. В дальнейшем они метаболизируются до глюкозы в кишечнике и оттуда всасываются в кровь.
Слюнные железы расщепляют только часть крахмала. Амилаза слюны активна в течение короткого времени, пока пища прожевывается. После попадания в желудок фермент инактивируется его кислым содержимым. Большая часть крахмала расщепляется уже в 12-перстной кишке под действием панкреатической амилазы, вырабатываемой поджелудочной железой.
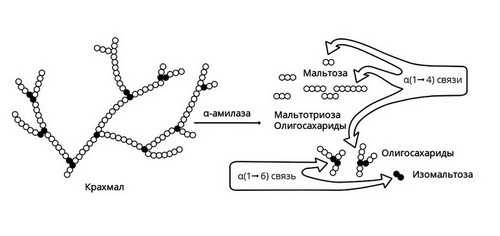
Рис. 2 — Амилаза начинает расщепление крахмала
Короткие углеводы, образовавшиеся под действием панкреатической амилазы, попадают в тонкий кишечник. Здесь с помощью мальтазы, лактазы, сахаразы, декстриназы они расщепляются до молекул глюкозы. Нерасщепляющаяся ферментами клетчатка выводится из кишечника с каловыми массами.
Протеазы
Белки или протеины — существенная часть человеческого рациона. Для их расщепления необходимы ферменты – протеазы. Они различаются по месту синтеза, субстратам и другим характеристикам. Некоторые из них активны в желудке, например, пепсин. Другие вырабатываются поджелудочной железой и активны в просвете кишечника. В самой железе выделяется неактивный предшественник фермента – химотрипсиноген, который начинает действовать только после смешивания с кислым пищевым содержимым, превращаясь в химотрипсин. Такой механизм помогает избежать самоповреждения протеазами клеток поджелудочной железы.
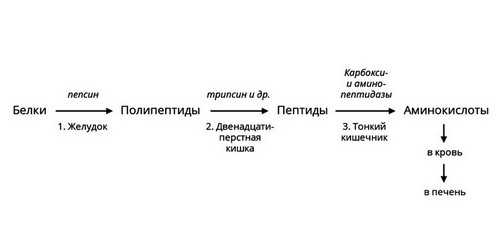
Рис. 3 — Ферментативное расщепление белков
Протеазы расщепляют пищевые белки на более мелкие фрагменты – полипептиды. Ферменты – пептидазы разрушают их до аминокислот, которые усваиваются в кишечнике.
Липазы
Пищевые жиры разрушаются ферментами-липазами, которые также вырабатываются поджелудочной железой. Они расщепляют молекулы жира на жирные кислоты и глицерин. Такая реакция требует наличия в просвете 12-перстной кишки желчи, образующейся в печени.
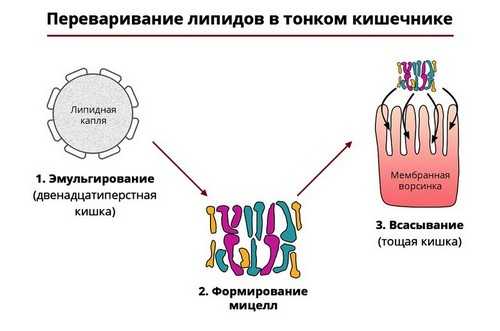
Рис. 4 — Ферментативный гидролиз жиров
Роль заместительной терапии препаратом «Микразим»
Для многих людей с нарушением пищеварения, прежде всего с заболеваниями поджелудочной железы, назначение ферментов обеспечивает функциональную поддержку органа и ускоряет процессы выздоровления. После купирования приступа панкреатита или другой острой ситуации прием ферментов можно прекратить, так как организм самостоятельно восстанавливает их секрецию.
Длительный прием ферментативных препаратов необходим лишь при тяжелой внешнесекреторной недостаточности поджелудочной железы.
Одним из наиболее физиологичных по своему составу является препарат «Микразим». В его состав входят амилаза, протеазы и липаза, содержащиеся в панкреатическом соке. Поэтому нет необходимости отдельно подбирать, какой фермент нужно использовать при разнообразных болезнях этого органа.
Показания для использования этого лекарства:
- хронический панкреатит, муковисцидоз и другие причины недостаточной секреции ферментов поджелудочной железы;
- воспалительные заболевания печени, желудка, кишечника, особенно после операций на них, для более быстрого восстановления пищеварительной системы;
- погрешности в питании;
- нарушение функции жевания, например, при стоматологических заболеваниях или малоподвижности пациента.
Прием пищеварительных ферментов с заместительной целью помогает избежать вздутия живота, жидкого стула, болей в животе. Кроме того, при тяжелых хронических заболеваниях поджелудочной железы Микразим полностью принимает на себя функцию по расщеплению питательных веществ. Поэтому они могут беспрепятственно усваиваться в кишечнике. Это особенно важно для детей, страдающих муковисцидозом.
Важно: перед применением ознакомьтесь с инструкцией или проконсультируйтесь с лечащим врачом.
micrazim.kz
📌 Ферменты — это… 🎓 Что такое Ферменты?
 Модель фермента нуклеозидфосфорилазы
Модель фермента нуклеозидфосфорилазыФерме́нты, или энзи́мы (от лат. fermentum, греч. ζύμη, ἔνζυμον — закваска) — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу).
Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы — повышают, ингибиторы — понижают).
Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
История изучения
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен[1].
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках.
Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастера с одной стороны, и М. Бертло и Ю. Либиха — с другой, о природе спиртового брожения. Собственно ферментами (от лат. fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а термин энзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска) предложен в 1876 году В. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено ещё несколько ферментов, и белковая природа ферментов была окончательно доказана.
Каталитическая активность РНК впервые была обнаружена в 1980-е годы у пре-рРНК Томасом Чеком, изучавшим сплайсинг РНК у инфузории Tetrahymena thermophila. Рибозимом оказался участок молекулы пре-рРНК Tetrahymena, кодируемый интроном внехромосомного гена рДНК; этот участок осуществлял аутосплайсинг, то есть сам вырезал себя при созревании рРНК.
Функции ферментов
Ферменты присутствуют во всех живых клетках и способствуют превращению одних веществ (субстратов) в другие (продукты). Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах — ими катализируется более 4000 разных биохимических реакций[2]. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10−10 моль/л и менее. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду.
Например, одна молекула фермента ренина, содержащегося в слизистой оболочке желудка телёнка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37 °C.
При этом эффективность ферментов значительно выше эффективности небелковых катализаторов — ферменты ускоряют реакцию в миллионы и миллиарды раз, небелковые катализаторы — в сотни и тысячи раз. См. также Каталитически совершенный фермент
Классификация ферментов
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
- КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа.
- КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
- КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза.
- КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
- КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
- КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счёт гидролиза АТФ. Пример: ДНК-полимераза.
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Соглашения о наименовании ферментов
Обычно ферменты именуют по типу катализируемой реакции, добавляя суффикс -аза к названию субстрата (например, лактаза — фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например, по оптимальному pH (щелочная фосфатаза) или локализации в клетке (мембранная АТФаза).
Кинетические исследования
 Кривая насыщения химической реакции, иллюстрирующая соотношение между концентрацией субстрата [S] и скоростью реакции v
Кривая насыщения химической реакции, иллюстрирующая соотношение между концентрацией субстрата [S] и скоростью реакции vПростейшим описанием кинетики[ru] односубстратных ферментативных реакций является уравнение Михаэлиса — Ментен (см. рис.). На сегодняшний момент описано несколько механизмов действия ферментов. Например, действие многих ферментов описывается схемой механизма «пинг-понг».
В 1972—1973 г.г. была создана первая квантово-механическая модель ферментативного катализа (авторы М. В. Волькенштейн, Р. Р. Догонадзе, З. Д. Урушадзе и др.)[3][4][5][6].
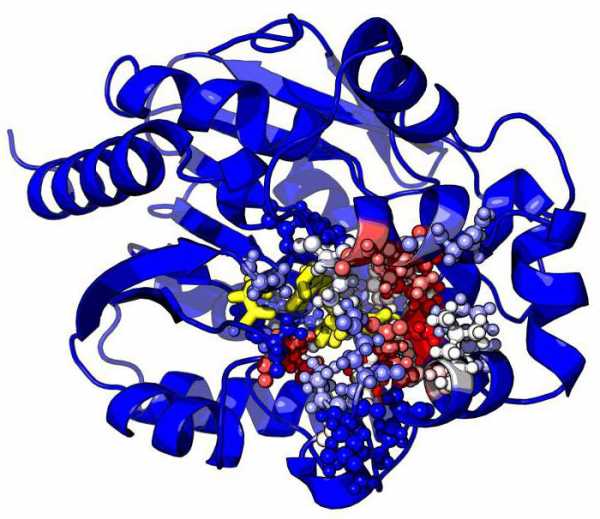
Структура и механизм действия ферментов
Активность ферментов определяется их трёхмерной структурой[7].
Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Несколько белковых цепей могут объединяться в белковый комплекс. Третичная структура белков разрушается при нагревании или воздействии некоторых химических веществ.
Активный центр ферментов
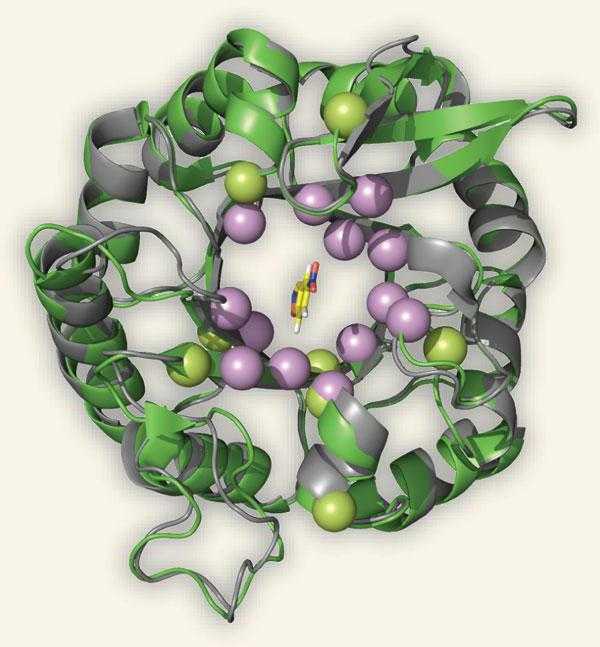
Изучение механизма химической реакции, катализируемой ферментом наряду с определением промежуточных и конечных продуктов на разных стадиях реакции подразумевает точное знание геометрии третичной структуры фермента, природы функциональных групп его молекулы, обеспечивающих специфичность действия и высокую каталитическую активность на данный субстрат, а также химической природы участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Обычно молекулы субстрата, участвующие в ферментативных реакциях, по сравнению с молекулами ферментов имеют относительно небольшие размеры. Таким образом, при образовании фермент-субстратных комплексов в непосредственное химическое взаимодействие вступают лишь ограниченные фрагменты аминокислотной последовательности полипептидной цепи — «активный центр» — уникальная комбинация остатков аминокислот в молекуле фермента, обеспечивающая непосредственное взаимодействие с молекулой субстрата и прямое участие в акте катализа[8].
В активном центре условно выделяют[8]:
- каталитический центр — непосредственно химически взаимодействующий с субстратом;
- связывающий центр (контактная или «якорная» площадка) — обеспечивающий специфическое сродство к субстрату и формирование комплекса фермент-субстрат.
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов или ионов металлов.
Фермент, соединяясь с субстратом:
- очищает субстрат от водяной «шубы»
- располагает реагирующие молекулы субстратов в пространстве нужным для протекания реакции образом
- подготавливает к реакции (например, поляризует) молекулы субстратов.
Обычно присоединение фермента к субстрату происходит за счет ионных или водородных связей, редко — за счет ковалентных. В конце реакции её продукт (или продукты) отделяются от фермента.
В результате фермент снижает энергию активации реакции. Это происходит потому, что в присутствии фермента реакция идет по другому пути (фактически происходит другая реакция), например:
В отсутствие фермента:
В присутствии фермента:
- А+Ф = АФ
- АФ+В = АВФ
- АВФ = АВ+Ф
где А, В — субстраты, АВ — продукт реакции, Ф — фермент.
Ферменты не могут самостоятельно обеспечивать энергией эндергонические реакции (для протекания которых требуется энергия). Поэтому ферменты, осуществляющие такие реакции, сопрягают их с экзергоническими реакциями, идущими с выделением большего количества энергии. Например, реакции синтеза биополимеров часто сопрягаются с реакцией гидролиза АТФ.
Для активных центров некоторых ферментов характерно явление кооперативности.
Специфичность
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (образуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептидную связь, следующую за многими аминокислотами.
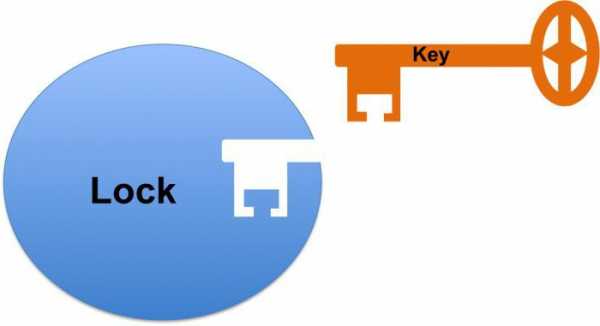
Модель «ключ-замок»
Гипотеза Кошланда об индуцированном соответствии Более реалистичная ситуация в случае индуцированного соответствия. Неправильные субстраты — слишком большие или слишком маленькие — не подходят к активному центруВ 1890 г. Эмиль Фишер предположил, что специфичность ферментов определяется точным соответствием формы фермента и субстрата[9]. Такое предположение называется моделью «ключ-замок». Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса. Однако, хотя эта модель объясняет высокую специфичность ферментов, она не объясняет явления стабилизации переходного состояния, которое наблюдается на практике.
Модель индуцированного соответствия
В 1958 г. Дениел Кошланд предложил модификацию модели «ключ-замок»[10]. Ферменты, в основном, — не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка».
Модификации
Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность в полной мере. Такие модификации называются посттрансляционными модификациями (процессингом). Один из самых распространенных типов модификации — присоединение химических групп к боковым остаткам полипептидной цепи. Например, присоединение остатка фосфорной кислоты называется фосфорилированием, оно катализируется ферментом киназой. Многие ферменты эукариот гликозилированы, то есть модифицированы олигомерами углеводной природы.
Ещё один распространенный тип посттранляционных модификаций — расщепление полипептидной цепи. Например, химотрипсин (протеаза, участвующая в пищеварении), получается при выщеплении полипептидного участка из химотрипсиногена. Химотрипсиноген является неактивным предшественником химотрипсина и синтезируется в поджелудочной железе. Неактивная форма транспортируется в желудок, где превращается в химотрипсин. Такой механизм необходим для того, чтобы избежать расщепления поджелудочной железы и других тканей до поступления фермента в желудок. Неактивный предшественник фермента называют также «зимогеном».
Кофакторы ферментов
Некоторые ферменты выполняют каталитическую функцию сами по себе, безо всяких дополнительных компонентов. Однако есть ферменты, которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами.
Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апо-фермент. Апо-фермент в комплексе с кофактором носит название холо-фермента. Большинство кофакторов связано с ферментом нековалентными, но довольно прочными взаимодействиями. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе.
Регуляция работы ферментов
У некоторых ферментов есть сайты связывания малых молекул, они могут быть субстратами или продуктами метаболического пути, в который входит фермент. Они уменьшают или увеличивают активность фермента, что создает возможность для обратной связи.
Ингибирование конечным продуктом
Метаболический путь — цепочка последовательных ферментативных реакций. Часто конечный продукт метаболического пути является ингибитором фермента, ускоряющего первую из реакций данного метаболического пути. Если конечного продукта слишком много, то он действует как ингибитор для самого первого фермента, а если после этого конечного продукта стало слишком мало, то первый фермент опять активируется. Таким образом, ингибирование конечным продуктом по принципу отрицательной обратной связи — важный способ поддержания гомеостаза (относительного постоянства условий внутренней среды организма).
Влияние условий среды на активность ферментов
Активность ферментов зависит от условий в клетке или организме — давления, кислотности среды, температуры, концентрации растворённых солей (ионной силы раствора) и др.
Множественные формы ферментов
Множественные формы ферментов можно разделить на две категории:
- Изоферменты
- Собственно множественные формы (истинные)
Изоферменты — это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию. Виды изоферментов:
- Органные — ферменты гликолиза в печени и мышцах.
- Клеточные — малатдегидрогеназа цитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию).
- Гибридные — ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа — 4 субъединицы 2 типов).
- Мутантные — образуются в результате единичной мутации гена.
- Аллоферменты — кодируются разными аллелями одного и того же гена.
Собственно множественные формы (истинные) — это ферменты, синтез которых кодируется одним и тем же аллелем одного и того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомах они подвергаются модификации и становятся разными, хотя и катализируют одну и ту же реакцию.
Изоферменты разные на генетическом уровне и отличаются от первичной последовательности, а истинные множественные формы становятся разными на посттрансляционном уровне.
Медицинское значение
Связь между ферментами и наследственными болезнями обмена веществ была впервые установлена А. Гэрродом[ru] в 1910-е гг. Гэррод назвал заболевания, связанные с дефектами ферментов, «врожденными ошибками метаболизма».
Если происходит мутация в гене, кодирующем определенный фермент, может измениться аминокислотная последовательность фермента. При этом в результате большинства мутаций его каталитическая активность снижается или полностью пропадает. Если организм получает два таких мутантных гена (по одному от каждого из родителей), в организме перестает идти химическая реакция, которую катализирует данный фермент. Например, появление альбиносов связано с прекращением выработки фермента тирозиназы, отвечающего за одну из стадий синтеза темного пигмента меланина. Фенилкетонурия связана с пониженной или отсутствующей активностью фермента фенилаланин-4-гидроксилазы в печени.
В настоящее время известны сотни наследственных заболеваний, связанные с дефектами ферментов. Разработаны методы лечения и профилактики многих из таких болезней.
Практическое использование
Ферменты широко используются в народном хозяйстве — пищевой, текстильной промышленности, в фармакологии и медицине. Большинство лекарств влияют на течение ферментативных процессов в организме, запуская или приостанавливая те или иные реакции.
Ещё шире область использования ферментов в научных исследованиях и в медицине.
Примечания
- ↑ Williams, Henry Smith, 1863—1943. A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences
- ↑ Bairoch A. The ENZYME database in 2000 Nucleic Acids Res 28:304-305(2000).
- ↑ Волькенштейн М. В., Догонадзе Р. Р., Мадумаров А. К., Урушадзе З. Д., Харкац Ю. И. К теории ферментативного катализа.- Молекулярная Биология, т. 6, вып. 3, 1972, ст. 431—439
- ↑ Волькенштейн М. В., Догонадзе Р. Р., Мадумаров А. К., Урушадзе З. Д., Харкац Ю. И. Электронно-конформационные взаимодействия в ферментативном катализе.- Сб. «Конформационные изменения биополимеров в растворах», изд-во «Наука», Москва, 1972
- ↑ Урушадзе З. Д., Хидурели В. К. Квантовый расчет кинетики Элементарного акта биохимических реакций.- Сб. «Биохимия растений», т.1, изд-во «Мецниереба», Тбилиси, 1973
- ↑ Urushadze Z. About a Real Conceptual Framework for Enzyme Catalysis.- Bull. Georg. Natl. Acad. Sci., Vol. 173, No 2, Tbilisi, 2006, pp. 421—424
- ↑ Anfinsen C.B. Principles that Govern the Folding of Protein Chains Science 20 July 1973: 223—230
- ↑ 1 2 Березов Т. Т., Коровкин Б. Ф. Биологическая химия: Учебник / Под. ред. акад. АМН СССР С. С. Дебова.— 2-е изд., перераб. и доп.— М.: Медицина,— 1990.— 528 с., С 99-102. ISBN 5-225-01515-8
- ↑ Fischer E, «Einfluss der Configuration auf die Wirkung der Enzyme» Ber. Dt. Chem. Ges. 1894 v27, 2985—2993.
- ↑ Koshland DE, Application of a Theory of Enzyme Specificity to Protein Synthesis. Proc. Natl. Acad. Sci. U.S.A. 1958 Feb;44(2):98-104.
Литература
- Волькенштейн М. В., Догонадзе Р. Р., Мадумаров А. К., Урушадзе З. Д., Харкац Ю. И. К теории ферментативного катализа.- Молекулярная биология, т. 6, вып. 3, 1972, ст. 431—439.
- Диксон, М. Ферменты / М. Диксон, Э. Уэбб. — В 3-х т. — Пер. с англ. — Т.1-2. — М.: Мир, 1982. — 808 с.
- Koshland D. The Enzymes, V. I, Ch. 7. New York, Acad. Press, 1959.
- Urushadze Z. About a Real Conceptual Framework for Enzyme Catalysis.- Bull. Georg. Natl. Acad. Sci., Vol. 173, No 2, 2006, 421—424.
dic.academic.ru
Биохимия ферментов. Строение, свойства и функции
В клетке любого живого организма протекают миллионы химических реакций. Каждая из них имеет большое значение, поэтому важно поддерживать скорость биологических процессов на высоком уровне. Почти каждая реакция катализируется своим ферментом. Что такое ферменты? Какова их роль в клетке?
Ферменты. Определение
Термин «фермент» происходит от латинского fermentum – закваска. Также они могут называться энзимами от греческого en zyme – «в дрожжах».
Ферменты – биологически активные вещества, поэтому любая реакция, протекающая в клетке, не обходится без их участия. Эти вещества выполняют роль катализаторов. Соответственно, любой фермент обладает двумя основными свойствами:
1) Энзим ускоряет биохимическую реакцию, но при этом не расходуется.
2) Величина константы равновесия не меняется, а лишь ускоряется достижение этого значения.
Ферменты ускоряют биохимические реакции в тысячу, а в некоторых случаях в миллион раз. Это значит, что при отсутствии ферментативного аппарата все внутриклеточные процессы практически остановятся, а сама клетка погибнет. Поэтому роль ферментов как биологически активных веществ велика.
Разнообразие энзимов позволяет разносторонне регулировать метаболизм клетки. В любом каскаде реакций принимает участие множество ферментов различных классов. Биологические катализаторы обладают большой избирательностью благодаря определенной конформации молекулы. Т. к. энзимы в большинстве случаев имеют белковую природу, они находятся в третичной или четвертичной структуре. Объясняется это опять же специфичностью молекулы.
Функции энзимов в клетке
Главная задача фермента – ускорение соответствующей реакции. Любой каскад процессов, начиная с разложения пероксида водорода и заканчивая гликолизом, требует присутствия биологического катализатора.
Правильная работа ферментов достигается высокой специфичностью к определенному субстрату. Это значит, что катализатор может ускорять только определенную реакцию и никакую больше, даже очень похожую. По степени специфичности выделяют следующие группы энзимов:
1) Ферменты с абсолютной специфичностью, когда катализируется только одна-единственная реакция. Например, коллагеназа расщепляет коллаген, а мальтаза расщепляет мальтозу.
2) Ферменты с относительной специфичностью. Сюда входят такие вещества, которые могут катализировать определенный класс реакций, к примеру, гидролитическое расщепление.
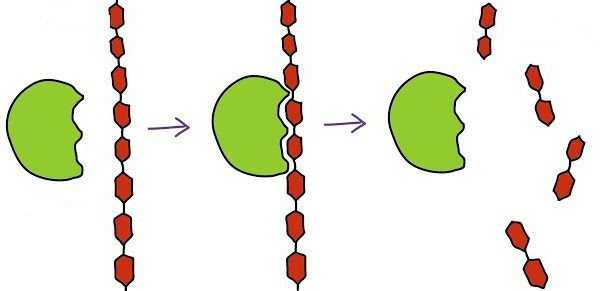
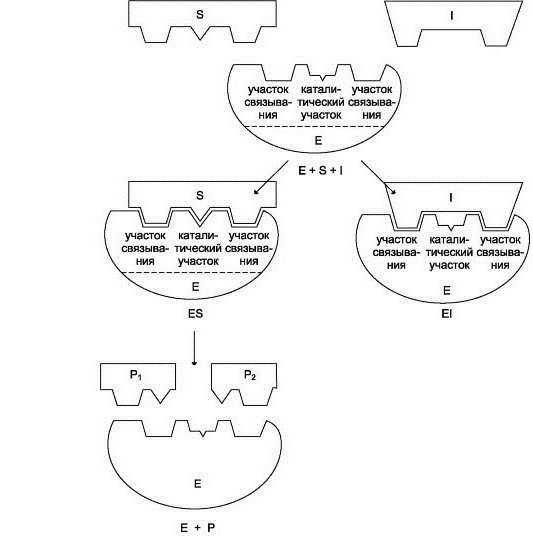
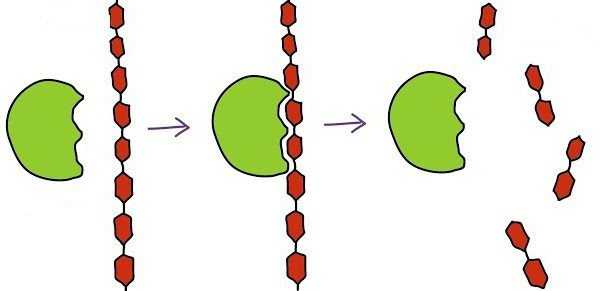
Работа биокатализатора начинается с момента присоединения его активного центра к субстрату. При этом говорят о комплементарном взаимодействии наподобие замка и ключа. Здесь имеется в виду полное совпадение формы активного центра с субстратом, что дает возможность ускорять реакцию.
Следующий этап заключается в протекании самой реакции. Ее скорость возрастает благодаря действию ферментативного комплекса. В конечном итоге мы получаем энзим, который связан с продуктами реакции.
Заключительный этап – отсоединение продуктов реакции от фермента, после чего активный центр вновь становится свободным для очередной работы.
Схематично работу фермента на каждом этапе можно записать так:
1) S + E ——> SE
2) SE ——> SP
3) SP ——> S + P , где S – это субстрат, E – фермент, а P – продукт.
Классификация ферментов
В организме человека можно найти огромное количество ферментов. Все знания об их функциях и работе были систематизированы, и в итоге появилась единая классификация, благодаря которой можно легко определить, для чего предназначен тот или иной катализатор. Здесь представлены 6 основных классов энзимов, а также примеры некоторых подгрупп.
- Оксидоредуктазы.
Ферменты этого класса катализируют окислительно-восстановительные реакции. Всего выделяют 17 подгрупп. Оксидоредуктазы обычно имеют небелковую часть, представленную витамином или гемом.
Среди оксидоредуктаз часто встречаются следующие подгруппы:
а) Дегидрогеназы. Биохимия ферментов-дегидрогеназ заключается в отщеплении атомов водорода и переносе их на другой субстрат. Эта подгруппа чаще всего встречается в реакциях дыхания, фотосинтеза. В составе дегидрогеназ обязательно присутствует кофермент в виде НАД/НАДФ или флавопротеидов ФАД/ФМН. Нередко встречаются ионы металлов. Примерами могут служить такие энзимы, как цитохромредуктазы, пируватдегидрогеназа, изоцитратдегидрогеназа, а также многие ферменты печени (лактатдегидрогеназа, глутаматдегидрогеназа и т. д.).
б) Оксидазы. Ряд ферментов катализирует присоединение кислорода к водороду, в результате чего продуктами реакции могут быть вода или пероксид водорода (H20, H202). Примеры ферментов: цитохромоксидаза, тирозиназа.
в) Пероксидазы и каталазы – энзимы, катализирующие распад H2O2 на кислород и воду.
г) Оксигеназы. Эти биокатализаторы ускоряют присоединение кислорода к субстрату. Дофамингидроксилаза – один из примеров таких энзимов.
2. Трансферазы.
Задача ферментов этой группы состоит в переносе радикалов от вещества-донора к веществу-реципиенту.
а) Метилтрансферазы. ДНК-метилтрансферазы – основные ферменты, контролирующие процесс репликации ДНК. Метилирование нуклеотидов играет большую роль в регуляции работы нуклеиновой кислоты.
б) Ацилтрансферазы. Энзимы этой подгруппы транспортируют ацильную группу с одной молекулы на другую. Примеры ацилтрансфераз: лецитинхолестеринацилтрансфераза (переносит функциональную группу с жирной кислоты на холестерин), лизофосфатидилхолинацилтрансфераза (ацильная группа переносится на лизофосфатидилхолин).
в) Аминотрансферазы – ферменты, которые участвуют в превращении аминокислот. Примеры ферментов: аланинаминотрансфераза, которая катализирует синтез аланина из пирувата и глутамата путем переноса аминогруппы.
г) Фосфотрансферазы. Ферменты этой подгруппы катализируют присоединение фосфатной группы. Другое название фосфотрансфераз, киназы, встречается намного чаще. Примерами могут служить такие энзимы, как гексокиназы и аспартаткиназы, которые присоединяют фосфорные остатки к гексозам (чаще всего к глюкозе) и к аспарагиновой кислоте соответственно.
3. Гидролазы – класс энзимов, которые катализируют расщепление связей в молекуле с последующим присоединением воды. Вещества, которые относятся к этой группе, — основные ферменты пищеварения.
а) Эстеразы – разрывают эфирные связи. Пример – липазы, которые расщепляют жиры.
б) Гликозидазы. Биохимия ферментов этого ряда заключается в разрушении гликозидных связей полимеров (полисахаридов и олигосахаридов). Примеры: амилаза, сахараза, мальтаза.
в) Пептидазы – энзимы, катализирующие разрушение белков до аминокислот. К пептидазам относятся такие ферменты, как пепсины, трипсин, химотрипсин, карбоиксипептидаза.
г) Амидазы – расщепляют амидные связи. Примеры: аргиназа, уреаза, глутаминаза и т. д. Многие ферменты-амидазы встречаются в орнитиновом цикле.
4. Лиазы – ферменты, по функции схожие с гидролазами, однако при расщеплении связей в молекулах не затрачивается вода. Энзимы этого класса всегда имеют в составе небелковую часть, например, в виде витаминов В1 или В6.
а) Декарбоксилазы. Эти ферменты действуют на С-С связь. Примерами могут служить глутаматдекарбоксилаза или пируватдекарбоксилаза.
б) Гидратазы и дегидратазы – ферменты, которые катализируют реакцию расщепления связей С-О.
в) Амидин-лиазы – разрушают С-N связи. Пример: аргининсукцинатлиаза.
г) Р-О лиазы. Такие ферменты, как правило, отщепляют фосфатную группу от вещества-субстрата. Пример: аденилатциклаза.
Биохимия ферментов основана на их строении
Способности каждого энзима определяются индивидуальным, только ему свойственным строением. Любой фермент – это, прежде всего, белок, и его структура и степень сворачивания играют решающую роль в определении его функции.
Для каждого биокатализатора характерно наличие активного центра, который, в свою очередь, делится на несколько самостоятельных функциональных областей:
1) Каталитический центр – это специальная область белка, по которой происходит присоединение фермента к субстрату. В зависимости от конформации белковой молекулы каталитический центр может принимать разнообразную форму, которая должна соответствовать субстрату так же, как замок ключу. Такая сложная структура объясняет то, что ферментативный белок находится в третичном или четвертичном состоянии.
2) Адсорбционный центр – выполняет роль «держателя». Здесь в первую очередь происходит связь между молекулой фермента и молекулой-субстратом. Однако связи, которые образует адсорбционный центр, очень слабые, а значит, каталитическая реакция на этом этапе обратима.
3) Аллостерические центры могут располагаться как в активном центре, так и по всей поверхности фермента в целом. Их функция – регулирование работы энзима. Регулирование происходит с помощью молекул-ингибиторов и молекул-активаторов.
Активаторные белки, связываясь с молекулой фермента, ускоряют его работу. Ингибиторы же, напротив, затормаживают каталитическую активность, причем это может происходить двумя способами: либо молекула связывается с аллостерическим центром в области активного центра фермента (конкурентное ингибирование), либо она присоединяется к другой области белка (неконкурентное ингибирование). Конкурентное ингибирование считается более действенным. Ведь при этом закрывается место для связывания субстрата с ферментом, причем этот процесс возможен только в случае практически полного совпадения формы молекулы ингибитора и активного центра.
Энзим зачастую состоит не только из аминокислот, но и из других органических и неорганических веществ. Соответственно, выделяют апофермент – белковую часть, кофермент – органическую часть, и кофактор – неорганическую часть. Кофермент может быть представлен улгеводами, жирами, нуклеиновыми кислотами, витаминами. В свою очередь, кофактор – это чаще всего вспомогательные ионы металлов. Активность ферментов определяется его строением: дополнительные вещества, входящие в состав, меняют каталитические свойства. Разнообразные виды ферментов – это результат комбинирования всех перечисленных факторов образования комплекса.
Регуляция работы ферментов
Энзимы как биологически активные вещества не всегда необходимы организму. Биохимия ферментов такова, что они могут в случае чрезмерного катализа навредить живой клетке. Для предотвращения пагубного влияния энзимов на организм необходимо каким-то образом регулировать их работу.
Т. к. ферменты имеют белковую природу, они легко разрушаются при высоких температурах. Процесс денатурации обратим, однако он может существенно повлиять на работу веществ.
pH также играет большую роль в регуляции. Наибольшая активность ферментов, как правило, наблюдается при нейтральных значениях pH (7,0-7,2). Также есть энзимы, которые работают только в кислой среде или только в щелочной. Так, в клеточных лизосомах поддерживается низкий pH, при котором активность гидролитических ферментов максимальна. В случае их случайного попадания в цитоплазму, где среда уже ближе к нейтральной, их активность снизится. Такая защита от «самопоедания» основана на особенностях работы гидролаз.
Стоит упомянуть о значении кофермента и кофактора в составе ферментов. Наличие витаминов или ионов металла существенно влияет на функционирование некоторых специфических энзимов.
Номенклатура ферментов
Все ферменты организма принято называть в зависимости от их принадлежности к какому-либо из классов, а также по субстрату, с которым они вступают в реакцию. Иногда по систематической номенклатуре используют в названии не один, а два субстрата.
Примеры названия некоторых энзимов:
- Ферменты печени: лактат-дегидроген-аза, глутамат-дегидроген-аза.
- Полное систематическое название фермента: лактат-НАД+-оксидоредукт-аза.
Сохранились и тривиальные названия, которые не придерживаются правил номенклатуры. Примерами являются пищеварительные ферменты: трипсин, химотрипсин, пепсин.
Процесс синтеза ферментов
Функции ферментов определяются еще на генетическом уровне. Т. к. молекула по большому счету – белок, то и ее синтез в точности повторяет процессы транскрипции и трансляции.
Синтез ферментов происходит по следующей схеме. Вначале с ДНК считывается информация о нужном энзиме, в результате чего образуется мРНК. Матричная РНК кодирует все аминокислоты, которые входят в состав энзима. Регуляция ферментов может происходить и на уровне ДНК: если продукта катализируемой реакции достаточно, транскрипция гена прекращается и наоборот, если возникла потребность в продукте, активизируется процесс транскрипции.
После того как мРНК вышла в цитоплазму клетки, начинается следующий этап – трансляция. На рибосомах эндоплазматической сети синтезируется первичная цепочка, состоящая из аминокислот, соединенных пептидными связями. Однако молекула белка в первичной структуре еще не может выполнять свои ферментативные функции.
Активность ферментов зависит от структуры белка. На той же ЭПС происходит скручивание протеина, в результате чего образуются сначала вторичная, а потом третичная структуры. Синтез некоторых ферментов останавливается уже на этом этапе, однако для активизации каталитической активности зачастую необходимо присоединение кофермента и кофактора.
В определенных областях эндоплазматической сети происходит присоединение органических составляющих энзима: моносахаридов, нуклеиновых кислот, жиров, витаминов. Некоторые ферменты не могут работать без наличия кофермента.
Кофактор играет решающую роль в образовании четвертичной структуры белка. Некоторые функции ферментов доступны только при достижении белком доменной организации. Поэтому для них очень важно наличие четвертичной структуры, в которой соединяющим звеном между несколькими глобулами белка является ион металла.
Множественные формы ферментов
Встречаются ситуации, когда необходимо наличие нескольких энзимов, катализирующих одну и ту же реакцию, но отличающихся друг от друга по каким-либо параметрам. Например, фермент может работать при 20 градусах, однако при 0 градусов он уже не сможет выполнять свои функции. Что делать в подобной ситуации живому организму при низких температурах среды?
Эта проблема легко решается наличием сразу нескольких ферментов, катализирующих одну и ту же реакцию, но работающих в разных условиях. Существуют два типа множественных форм энзимов:
- Изоферменты. Такие белки кодируются разными генами, состоят из разных аминокислот, однако катализируют одну и ту же реакцию.
- Истинные множественные формы. Эти белки транскрибируются с одного и того же гена, однако на рибосомах происходит модификация пептидов. На выходе получают несколько форм одного и того же фермента.
В результате первый тип множественных форм сформирован на генетическом уровне, когда второй – на посттрансляционном.
Значение ферментов
Использование ферментов в медицине сводится к выпуску новых лекарственных средств, в составе которых вещества уже находятся в нужных количествах. Ученые еще не нашли способ стимулирования синтеза недостающих энзимов в организме, однако сегодня широко распространены препараты, которые могут на время восполнить их недостаток.
Различные ферменты в клетке катализируют большое количество реакций, связанных с поддержанием жизнедеятельности. Одними из таких энизмов являются представители группы нуклеаз: эндонуклеазы и экзонуклеазы. Их работа заключается в поддержании постоянного уровня нуклеиновых кислот в клетке, удалении поврежденных ДНК и РНК.
Не стоит забывать о таком явлении, как свертывание крови. Являясь эффективной мерой защиты, данный процесс находится под контролем ряда ферментов. Главным из них является тромбин, который переводит неактивный белок фибриноген в активный фибрин. Его нити создают своеобразную сеть, которая закупоривает место повреждения сосуда, тем самым препятствуя излишней кровопотере.
Ферменты используются в виноделии, пивоварении, получении многих кисломолочных продуктов. Для получения спирта из глюкозы могут использоваться дрожжи, однако для удачного протекания этого процесса достаточно и экстракта из них.
Интересные факты, о которых вы не знали
— Все ферменты организма имеют огромную массу — от 5000 до 1000000 Да. Это связано с наличием белка в составе молекулы. Для сравнения: молекулярная масса глюкозы — 180 Да, а углекислого газа — всего 44 Да.
— На сегодняшний день открыто более чем 2000 ферментов, которые были обнаружены в клетках различных организмов. Однако большинство из этих веществ до конца еще не изучено.
— Активность ферментов используется для получения эффективных стиральных порошков. Здесь энзимы выполняют ту же роль, что и в организме: они разрушают органические вещества, и это свойство помогает в борьбе с пятнами. Рекомендуется использовать подобный стиральный порошок при температуре не выше 50 градусов, иначе может пойти процесс денатурации.
— По статистике, 20% людей по всему миру страдает от недостатка какого-либо из ферментов.
— О свойствах энзимов знали очень давно, однако только в 1897 году люди поняли, что для сбраживания сахара в спирт можно использовать не сами дрожжи, а экстракт из их клеток.
fb.ru
Классификация ферментов
В настоящее время известно более 4000 ферментов. Их разделяют на шесть классов в зависимости от типа катализируемой реакции. Классы разделяются на подклассы, на под-подклассы и, наконец, на отдельные ферменты. Каждый фермент имеет шифр, состоящий из четырех чисел.
Первый класс ферментов называется оксидоредуктазы. К нему относятся ферменты, катализирующие окислительно-восстановительные реакции.
Окислительно-восстановительные процессы в клетке могут осуществляться тремя путями: переносом иона водорода, присоединением кислорода и переносом электронов.
Наиболее распространенными оксидоредуктазами являются дегидрогеназы, осуществляющие перенос водорода. В состав дегидрогеназ могут входить в качестве кофермента НАД+ (никотинамид аденин дину клеотид) или НАДФ+ (никотинамидаденинди-нуклеотидфосфат), а также ФАД (флавинадениндинуклеотид) или ФМН (флавинмононуклеотид). В состав НАД+ и НАДФ+ входит витамин РР, а в состав ФАД и ФМН — витамин В2. Эти коферменты представляют собой сложные соединения — производные нуклеотидов.
Дегидрогеназы играют важную роль в таких процессах, как фотосинтез, брожение и дыхание. Дегидрогеназы катализируют ряд реакций цикла Кребса. Алкогольдегидрогеназа и лактатдегидрогеназа участвуют, соответственно, в спиртовом и молочнокислом брожении.
Биологическое окисление, связанное с переносом водорода и осуществляемое при участии дегидрогеназ, сопровождается высвобождением энергии, которая запасается в клетках в виде АТФ.
Оксидоредуктазы, для которых акцептором водорода служит только кислород воздуха, называют оксидазами.
Среди оксидоредуктаз важное значение имеют еще два фермента — каталаза и пероксидаза. Оба эти фермента разрушают ядовитую для живой клетки перекись водорода.
Оксидоредуктазы, катализирующие реакции присоединения к окисляемому субстрату кислорода воздуха, называются оксигеназами. К ним относится, например, фермент липоксигеназа, который катализирует окисление кислородом воздуха ненасыщенных высокомолекулярных жирных кислот.
Второй класс ферментов называется трансферазы. Это ферменты, которые катализируют реакции переноса каких-либо химических групп с одного вещества на другое. Существует несколько подклассов трансфераз, например:
- гликозилтрансферазы — ферменты, которые переносят остатки моносахаридов, например, глюкозы, с одного вещества на другое;
- аминотрансферазы — ферменты, катализирующие реакции переноса аминогрупп, например, в реакциях переаминирования между аминокислотами и кетокислотами.
Третий класс ферментов называется гидролазы. Сюда относят ферменты, катализирующие реакции гидролиза сложных органических веществ. При гидролизе вода присоединяется по месту разрыва химической связи. Наиболее важные подклассы гидролаз — это эстеразы, гликозидазы и пептидгидролазы.
Эстеразы — это ферменты, осуществляющие гидролиз по сложноэфирной связи; в результате образуются спирт и органическая кислота. Среди эстераз наибольшее значение имеет фермент липаза, которая катализирует гидролиз жиров.
Гликозидазы — это ферменты, гидролизующие ди-, три — и полисахариды по гликозидным связям. К наиболее значимым гликозидазам можно отнести: β-фруктофуранозидазу, которая осуществляет гидролиз сахарозы; α-глюкозидазу, которая гидролизует мальтозу; α-амилазу и β-амилазу, гидролизующие крахмал.
Пептидгидролазы (протеазы) — это ферменты, которые гидролизуют пептиды и белки, расщепляя в них пептидные связи. Они разделяются на две группы: пептидазы и протеиназы. Пептидазы осуществляют гидролиз концевых пептидных связей в белках и пептидах. Протеиназы гидролизуют полипептиды, расщепляя в них глубинные пептидные связи.
Таким образом, гидролиз белка осуществляется при совместном действии протеиназ и пептидаз. Промежуточными продуктами гидролиза являются различные пептиды, а конечными — свободные аминокислоты.
Среди протеиназ важное место занимают трипсин, пепсин и папаин.
Трипсин вырабатывается поджелудочной железой. Оптимум активности фермента находится в щелочной среде (рН
www.activestudy.info
📌 ФЕРМЕНТЫ — это… 🎓 Что такое ФЕРМЕНТЫ?
Продукт тоже можно считать субстратом, поскольку все ферментативные реакции в той или иной степени обратимы. Правда, обычно равновесие сдвинуто в сторону образования продукта, и обратную реакцию бывает трудно зафиксировать.
Скорость ферментативной реакции зависит от концентрации субстрата [[S]] и количества присутствующего фермента. Эти величины определяют, сколько молекул фермента соединится с субстратом, и именно от содержания фермент-субстратного комплекса зависит скорость реакции, катализируемой данным ферментом. В большинстве ситуаций, представляющих интерес для биохимиков, концентрация фермента очень мала, а субстрат присутствует в избытке. Кроме того, биохимики исследуют процессы, достигшие стационарного состояния, при котором образование фермент-субстратного комплекса уравновешивается его превращением в продукт. В этих условиях зависимость скорости (v) ферментативного превращения субстрата от его концентрации [[S]] описывается уравнением Михаэлиса — Ментен:
где KM — константа Михаэлиса, характеризующая активность фермента, V — максимальная скорость реакции при данной суммарной концентрации фермента. Из этого уравнения следует, что при малых [[S]] скорость реакции возрастает пропорционально концентрации субстрата. Однако при достаточно большом увеличении последней эта пропорциональность исчезает: скорость реакции перестает зависеть от [[S]] — наступает насыщение, когда все молекулы фермента оказываются занятыми субстратом. Выяснение механизмов действия ферментов во всех деталях — дело будущего, однако некоторые важные их особенности уже установлены. Каждый фермент имеет один или несколько активных центров, с которыми и связывается субстрат. Эти центры высокоспецифичны, т.е. «узнают» только «свой» субстрат или близкородственные соединения. Активный центр формируют особые химические группы в молекуле фермента, ориентированные друг относительно друга определенным образом. Происходящая так легко потеря ферментативной активности связана именно с изменением взаимной ориентации этих групп. Молекула субстрата, связанного с ферментом, претерпевает изменения, в результате которых разрываются одни и образуются другие химические связи. Чтобы этот процесс произошел, необходима энергия; роль фермента состоит в снижении энергетического барьера, который нужно преодолеть субстрату для превращения в продукт. Как именно обеспечивается такое снижение — до конца не установлено.
Ферментативные реакции и энергия. Высвобождение энергии при метаболизме питательных веществ, например при окислении шестиуглеродного сахара глюкозы с образованием диоксида углерода и воды, происходит в результате последовательных согласованных ферментативных реакций. В животных клетках в превращениях глюкозы в пировиноградную кислоту (пируват) или молочную кислоту (лактат) участвуют 10 разных ферментов. Этот процесс называется гликолизом. Первая реакция — фосфорилирование глюкозы — требует участия АТФ. На превращение каждой молекулы глюкозы в две молекулы пировиноградной кислоты расходуются две молекулы АТФ, но при этом на промежуточных этапах из аденозиндифосфата (АДФ) образуются 4 молекулы АТФ, так что весь процесс в целом дает 2 молекулы АТФ. Далее пировиноградная кислота окисляется до диоксида углерода и воды при участии ферментов, ассоциированных с митохондриями. Эти превращения образуют цикл, называемый циклом трикарбоновых кислот, или циклом лимонной кислоты.
См. также МЕТАБОЛИЗМ. Окисление одного вещества всегда сопряжено с восстановлением другого: первое отдает атом водорода, а второе его присоединяет. Катализируют эти процессы дегидрогеназы, обеспечивающие перенос атомов водорода от субстратов к коферментам. В цикле трикарбоновых кислот одни специфические дегидрогеназы окисляют субстраты с образованием восстановленной формы кофермента (никотинамиддинуклеотида, обозначаемого НАД), а другие окисляют восстановленный кофермент (НАДЧН), восстанавливая другие дыхательные ферменты, в том числе цитохромы (железосодержащие гемопротеины), в которых атом железа попеременно то окисляется, то восстанавливается. В конечном итоге восстановленная форма цитохромоксидазы, одного из ключевых железосодержащих ферментов, окисляется кислородом, попадающим в наш организм с вдыхаемым воздухом. Когда происходит горение сахара (окисление кислородом воздуха), входящие в его состав атомы углерода непосредственно взаимодействуют с кислородом, образуя диоксид углерода. В отличие от горения, при окислении сахара в организме кислород окисляет собственно железо цитохромоксидазы, но в конечном итоге его окислительный потенциал используется для полного окисления сахаров в ходе многоступенчатого процесса, опосредуемого ферментами. На отдельных этапах окисления энергия, заключенная в питательных веществах, высвобождается в основном маленькими порциями и может запасаться в фосфатных связях АТФ. В этом принимают участие замечательные ферменты, которые сопрягают окислительные реакции (дающие энергию) с реакциями образования АТФ (запасающими энергию). Этот процесс сопряжения известен как окислительное фосфорилирование. Не будь сопряженных ферментативных реакций, жизнь в известных нам формах была бы невозможна. Ферменты выполняют и множество других функций. Они катализируют разнообразные реакции синтеза, включая образование тканевых белков, жиров и углеводов. Для синтеза всего огромного множества химических соединений, обнаруженных в сложных организмах, используются целые ферментные системы. Для этого нужна энергия, и во всех случаях ее источником служат фосфорилированные соединения, такие, как АТФ.
ХИМИЧЕСКИЕ СОЕДИНЕНИЯ даны большими буквами, ферменты — маленькими. АТФ и АДФ — аденозинтрифосфат и аденозиндифосфат соответственно; НАД — никотинамиддинуклеотид (кофермент), окисленная форма; НАДЧН — восстановленная форма НАД.
ЦИКЛ ЛИМОННОЙ КИСЛОТЫ
Ферменты и пищеварение. Ферменты — необходимые участники процесса пищеварения. Только низкомолекулярные соединения могут проходить через стенку кишечника и попадать в кровоток, поэтому компоненты пищи должны быть предварительно расщеплены до небольших молекул. Это происходит в ходе ферментативного гидролиза (расщепления) белков до аминокислот, крахмала до сахаров, жиров до жирных кислот и глицерина. Гидролиз белков катализирует фермент пепсин, содержащийся в желудке. Ряд высокоэффективных пищеварительных ферментов секретирует в кишечник поджелудочная железа. Это трипсин и химотрипсин, гидролизующие белки; липаза, расщепляющая жиры; амилаза, катализирующая расщепление крахмала. Пепсин, трипсин и химотрипсин секретируются в неактивной форме, в виде т.н. зимогенов (проферментов), и переходят в активное состояние только в желудке и кишечнике. Это объясняет, почему указанные ферменты не разрушают клетки поджелудочной железы и желудка. Стенки желудка и кишечника защищает от пищеварительных ферментов и слой слизи. Некоторые важные пищеварительные ферменты секретируются клетками тонкого кишечника. Большая часть энергии, запасенной в растительной пище, такой, как трава или сено, сосредоточена в целлюлозе, которую расщепляет фермент целлюлаза. В организме травоядных животных этот фермент не синтезируется, и жвачные, например крупный рогатый скот и овцы, могут питаться содержащей целлюлозу пищей только потому, что целлюлазу вырабатывают микроорганизмы, заселяющие первый отдел желудка — рубец. С помощью микроорганизмов происходит переваривание пищи и у термитов. Ферменты находят применение в пищевой, фармацевтической, химической и текстильной промышленности. В качестве примера можно привести растительный фермент, получаемый из папайи и используемый для размягчения мяса. Ферменты добавляют также в стиральные порошки.
Ферменты в медицине и сельском хозяйстве. Осознание ключевой роли ферментов во всех клеточных процессах привело к широкому их применению в медицине и сельском хозяйстве. Нормальное функционирование любого растительного и животного организма зависит от эффективной работы ферментов. В основе действия многих токсичных веществ (ядов) лежит их способность ингибировать ферменты; таким же эффектом обладает и ряд лекарственных препаратов. Нередко действие лекарственного препарата или токсичного вещества можно проследить по его избирательному влиянию на работу определенного фермента в организме в целом или в той или иной ткани. Например, мощные фосфорорганические инсектициды и нервно-паралитические газы, разработанные в военных целях, оказывают свой губительный эффект, блокируя работу ферментов — в первую очередь холинэстеразы, играющей важную роль в передаче нервного импульса. Чтобы лучше понять механизм действия лекарственных препаратов на ферментные системы, полезно рассмотреть, как работают некоторые ингибиторы ферментов. Многие ингибиторы связываются с активным центром фермента — тем самым, с которым взаимодействует субстрат. У таких ингибиторов наиболее важные структурные особенности близки к структурным особенностям субстрата, и если в реакционной среде присутствуют и субстрат и ингибитор, между ними наблюдается конкуренция за связывание с ферментом; при этом чем больше концентрация субстрата, тем успешнее он конкурирует с ингибитором. Ингибиторы другого типа индуцируют в молекуле фермента конформационные изменения, в которые вовлекаются важные в функциональном отношении химические группы. Изучение механизма действия ингибиторов помогает химикам создавать новые лекарственные препараты.
НЕКОТОРЫЕ ФЕРМЕНТЫ И КАТАЛИЗИРУЕМЫЕ ИМИ РЕАКЦИИ
ЛИТЕРАТУРА
Фершт Э. Структура и механизм действия ферментов. М., 1980 Страйер Л. Биохимия, т. 1 (с. 104-131), т. 2 (с. 23-94). М., 1984-1985 Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохомия человека, т. 1. М., 1993
Энциклопедия Кольера. — Открытое общество. 2000.
dic.academic.ru
Ферменты
21
Катализаторами химических превращений в живых клетках являются вещества белко-вой природы, которые называют ферментами или энзимами. Здесь не только чисто лингвистическое расхождение. На начальном этапе развития биохимии шел спор меж-ду Л.Пастером с одной стороны и М.Бертло и Ю.Либихом с другой. Л.Пастер был убежден в том, что процесс брожения неотделим от дрожжевых клеток и осуществля-ющие это превращение катализаторы – организованные ферменты (от лат. fermentum – закваска) – от клеток неотделимы. М.Бертло и Ю.Либих оперировали понятием энзим (от гр. en — в, zyme — дрожжи, закваска), относя его к секретируемым клетками ката-лизаторам пищеварительных процессов – пепсину, трипсину, амилазе и др. Заблужде-ние Пастера было основано на том, что он проводил стерилизацию клеточных культур нагреванием, при котором шла и денатурация ферментов, а М.Бертло и Ю.Либих рабо-тали с ферментами из пищеварительных соков, не проводя их термическую обработку. В соответствии с этим одни и те же биокатализатры вне продуцирующей их клетки принято назвать энзимами, то есть ферменты в составе стирального порошка или таб-летки фестала – это энзимы. В биохимии, рассматривающей обменные процессы в клетках, речь обычно идет о ферментах, хотя относящийся к ним раздел биохимии называют энзимологией для того чтобы понятие было составлено только из греческих слов.
Работу ферментов выбрал для иллюстрации особенности биохимических процессов известный биохимик Сент-Дьердь. Он напомнил, что в гробнице Тутанхамона несколь-ко тысяч лет пролежала высохшая трапеза фараона, оставленная ему для загробной жизни. Будучи съеденной она превратилась бы в диоксид углерода, воду и другие продукты метаболизма в считанные часы.
Надо сказать, что начало биохимии в нашем сегодняшнем понимании было положено работами Э.Бухнера, показавшего, что после длительного перемешивания дрожжевых клеток с инфузорной землей происходит их разрушение, но полученный бесклеточный сок некоторое время сохраняет способность к сбраживанию глюкозы. На самом деле аналогичные опыты ставились намного раньше, например, за 25 лет до публикации Э.Бухнера появилась статья на эту тему М.М.Манасеиной (Коркуновой) на русском и немецком языках, были и более ранние сообщения.
Что же отличает ферменты, как катализаторы? В общем можно выделить три особенности:
Высокая эффективность. Под этим подразумевается, что реакция, которая в обыч-ных условиях идет очень медленно или вообще не идет, в присутствии фермента или мультиферментного комплекса протекает с очень высокой скоростью. Правда, скорость при этом понятие относительное. Если одна молекула пепсина вызывает расщепление примерно десяти пептидных связей в секунду, то молекула каталазы, разлагающая пероксид водорода на воду и кислород, осуществляет до миллиона превращений в секунду.
Ферменты высокоспецифичны по типу реакций, то есть каждый фермент катализи-рует только одну реакцию, например, глютаминовая кислота в присутствии соот-ветствующей декарбоксилазы превращается в -аминомасляную кислоту, а фермент, относящийся к трансаминазам, превращает ее в кетоглутаровую кислоту.
Ферменты чаще всего специфичны по субстрату. Например, превращение оксигруп-пы в карбонильную группу осуществляют ферменты, относящиеся к дегидрогена-зам, но этанол превращается в ацетальдегид алкогольдегидрогеназой, а молочная кислота в пировиноградную – лактатдегидрогеназой.
Из этого следует, что ферментов, осуществляющих все многообразие метаболических превращений, должно быть очень много. В 1930 году было известно всего лишь 80 ферментов, а в 1994 году – 3200. Долгое время безуспешно искали ферменты не только среди белков, но и среди других классов биополимеров, и лишь в последние годы было показано, что превращения определенных субстратов могут катализировать и некото-рые рибонуклеиновые кислоты, названные рибозимами.
Ферменты, выделенные и охарактеризованные на ранней стадии развития биохимии, получали имена собственные (трипсин, пепсин, тромбин), затем названия ферментов стали образовывать по названию субстратов с окончанием —аза (аргинин аргиназа, аспарагин аспарагиназа, мочевина уреаза и т.д.), но чаще всего название суб-страта дополняют типом осуществляемого ферментом химического превращения (лак-татдегидрогеназа, холинэстераза, супероксиддисмутаза). Обилие таких названий может напугать приступающего к изучению биохимии, но этот испуг легко преодолим, так как в конце концов даже специалисты имеют обычно дело с ограниченным числом биохимических превращений. Если выделять из биохимии раздел энзимологии, то такая путаница в названиях становится слишком обременительной, и поэтому была принята цифровая классификация ферментов, включающая четыре группы цифр: класс, подкласс, подподкласс и номер фермента в подподклассе. Исторически выделилось шесть групп ферментов.
Первая группа представлена оксидоредуктазами, они относятся к классу 1. Здесь можно выделить подкласс дегидрогеназ, то есть в число оксидоредуктаз входят фер-менты, катализирующие дегидрирование спиртовых групп до карбонильных групп, окисление карбонильных групп до карбоксильных, дегидрирование с образованием этиленовых соединений, дегидрирование групп СН-NН2, приводящее к образованию гидролизующихся до карбонильных групп иминов (C=NH), и так далее. Реакции дегид-рирования протекают по схеме:
Если атомы водорода или электроны непосредственно переносятся на кислород, то такие ферменты относятся к подклассу оксигеназ.
Второй класс представлен трансферазами — это ферменты, катализирующие перенос многоатомных фрагментов с одной молекулы на другую. Сюда входят, например, фер-менты, переносящие фосфатные остатки с аденозинтрифосфата на другие молекулы (фосфофруктокиназа), ферменты, переносящие одноуглеродные фрагменты (фолат-зависимые ферменты). Трансаминазы, обменивающие аминогруппы на карбонильные функции, также относятся к трансферазам.
Ферменты третьего класса называют гидролазами. Они катализируют перенос двух фрагментов молекулы на молекулу воды, то есть реакцию гидролиза. Если они гид-ролизуют пептидные связи в белках, то это протеазы или пептидазы. Отщепление С‑концевой аминокислоты катализирут карбопептидазы, а N-концевой – аминопепти-дазы. Катализ гидролитического расщепления нуклеиновых кислот осуществляют нуклеазы (ДНК-аза, РНК-аза).
Четвертый класс ферментов – это лиазы. Они катализируют расщепление субстрата с образованием кратной связи или, в обратном направлении, – присоединение по крат-ной связи (в этом варианте обратной реакции их называют обычно синтазами). В качестве примера можно привести карбоангидразу, катализирующую реакцию образо-вания бикарбоната из диоксида углерода и воды:
Еще один пример – декарбоксилазы:
К пятой группе относятся изомеразы. Это название уже характеризует тип катализи-руемых этими ферментами превращений. Можно только добавить, что наряду с прос-тыми изомеризациями, связанными, например, с переносом ацильной (фосфориль-ной) группы с одной гидроксильной группы на другую, изомеразы катализируют и бо-лее сложные реакции. Например, к ним относятся рацемазы и эпимеразы (если речь идет о получении другого диастереоизомера), а кобаламинзависимые изомеразы по свободнорадикальному механизму катализируют и перестройку углеродного скелета молекул. С их участием, например, метилмалоновая кислота в виде ее тиоэфира с коферментом А превращается в сукцинил-кофермент А:
Шестая группа ферментов – лигазы (синтетазы). Главная особенность этих ферментов состоит в том, что энергию, требуемую для протекания катализируемых ими превра-щений, поставляют макроэргические вещества, главным из которых является АТФ. Примером катализируемых лигазами реакций служит образование C-N, C-S и С-С-свя-зей (например, это образование пептидных связей, тиоэфиров и т.д.).
Набор функциональных групп в белковых аминокислотах не велик и с их помощью белковая молекула не может обеспечить катализ всех требуемых для протекания мета-болических процессов реакций. Вследствие этого во многих случаях к работе фермента подключаются вещества небелковой природы, которые могут быть связаны с белковой молекулой ковалентными связями, солевыми связями или же они могут образовывать более или менее прочные комплексы с белковой частью фермента, которую тогда на-зывают апоферментом. Связанные ковалентной связью небелковые составляющие фер-ментов обычно называют простетическими группами, а связанные с апоферментами водородными связями, солевыми, Ван-дер-Ваальсовыми или гидрофобными взаимо-действиями небелковые компоненты называют коферментами (в последнее время вхо-дит в употребление термин косубстрат, то есть вспомогательный субстрат). Облада-ющий каталитической активностью комплекс кофермента и апофермента, если это надо подчеркнуть, называют холоферментом. Кофермент или простетическая группа отвечает за химизм катализируемого превращения. Она также стабилизирует апофер-мент – вместе у них наиболее выгодная в энергетическом отношении структура, поэто-му апофермент без кофермента более легко денатурируется. Но белковая компонента не только определяет специфичность фермента по субстрату, обеспечивает связывание с субстратом и отход от каталитического центра продуктов реакции. В отдельных слу-чаях она определяет и химизм катализируемой реакции (активные центры трансаминаз и декарбоксилаз аминокислот включают один и тот же кофермент – пиридоксальфос-фат). Кроме коферментов или простетических групп в состав ферментов могут входить и кофакторы – чаще всего это ионы металлов, известные нам как микроэлементы.
Существуют, конечно, и ферменты, каталитический центр которых составлен только функциональными группами аминокислот, но и они чаще всего наиболее активны при наличии в их структуре кофакторов. Так, например, в работе каталитического центра сериновых гидролаз принимает участие ион цинка.
Особую роль в метаболических процессах играют аллостерические ферменты, молеку-лы которых, кроме каталитических центров, имеют еще и регуляторные участки. В ре-зультате связывания с ними веществ, называемых эффекторами, активность фермента может возрастать (положительный эффектор) или снижаться (отрицательный). Понят-но, что аллостерические ферменты устроены более сложно и имеют более высокую молекулярную массу.
Строение многих коферментов и простетических групп было установлено еще в трид-цатые годы прошлого века. Оказалось, что чаще всего они образуются в результате более или менее сложных превращений витаминов. Так, например, витамин В1 или тиамин, входит в состав лиаз, декарбоксилирующих -кетокислоты (пируватдекарбок-силаза, пируватдегидрогеназа, кетоглутаратдегидрогеназа) в виде эфира с пирофосфор-ной кислотой – тиаминпирофосфата:
Кофермент пиридоксальфосфат, принимающий участие в реакциях переаминирования (трансаминазы, относящиеся к трансферазам) и декарбоксилирования аминокислот (лиазы), точно так же образуется в результате монофосфорилирования витамина В6 – пиридоксаля:
и
Более сложная цепочка превращений ведет от витамина В3 – ниацина (так называют никотиновую кислоту и никотинамид) к коферменту реакций гидрирования-дегидрирования – никотинамидадениндинуклеотиду NAD+):
и
Еще одна группа ферментов, принимающих участие в реакциях гидрирования-дегидри-рования, представлена флавопротеинами (FMN и FAD – флавинмононуклеотид и флавинадениндинуклеотид), у которых донором-акцептором атомов водорода является рибофлавин (витамин В2):
Важную роль в окислительно-восстановительных превращениях в биологических сис-темах играют цитохромы (цито – от греч. kytos – вмещающее, клетка; хрома – цвет, окрашивание). В молекулах этих веществ белковая составляющая соединена тиоэфир-ной связью с железопорфирином, молекула которого представляет собой макроцикл из четырех пиррольных колец с метиновыми мостиками, с атомом железа в центре. В качестве примера здесь можно привести структуру гема – железопорфирина, входя-щего в состав гемоглобина и предназначенного для переноса молекулярного кисло-рода. Гем соединен с белковыми молекулами тиоэфирными связями, образовавшимися в результате присоединения сульфгидрильных групп из остатков цистеина по виниль-ным группам гема.
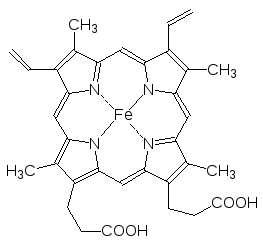
Цитохромы оксидоредуктаз, окрашенные в цвета от красного до коричневого, участ-вуют в переносе электронов (Fe+2 Fe+3 + e), например, когда образовавшиеся в реак-циях дегидрирования атомы водорода отдают соответствующим акцепторам свои электроны и превращаются в протоны. Цитохромы обозначают буквами латинского алфавита с цифровыми индексами, например а, а3, b, c1, с, f6, всего их известно более двадцати. В частности в цитохроме с феррипорфириновый фрагмент вместо остатков пропионовой кислоты содержит пропильные группы. Цитохромы участвуют также в реакциях окислительного гидроксилирования органических соединений, а пара цито-хромоксидаз а-а3 переносит четыре электрона на молекулу кислорода (дыхание).
Часто в учебниках по биохимии в качестве универсального кофермента реакций гидрирования-дегидрирования рассматривается и убихинон (ubi – по латыни значит везде, то есть вездесущий хинон). На самом деле существует несколько соединений этого класса, соответствующих формуле
В частности убихинон с n = 10 выделен из печени млекопитающих (кофермент Q, CoQ), однако это растворимое в клеточных липидах вещество никогда не бывает связано с белками и поэтому не может претендовать на роль истинного кофермента. На самом деле небольшой пул этого соединения растворен в липидном слое клеточных мембран и служит для одно- или двухэлектронного переноса между более жестко встроенными в мембрану переносчиками электронов.
Фолиевая кислота (витамин Вс) после ее превращения в тетрагидрофолиевую кислоту участвует в работе ферментов, переносящих одноуглеродные фрагменты (метильную, гидроксиметильную, формильную группу):
Среди ацилтрансфераз чаще всего встречаются ферменты, в работе которых принимает участие кофермент А, обозначаемый часто CoASH, В этом соединении пирофосфат-ный фрагмент 3-фосфоаденозиндифосфата соединен эфирной связью с пантотеновой кислотой, которая является обязательным фактором питания, иногда ее называют так-же витамином В5.
С участием АТФ или в результате обменной реакции с другим тиоэфиром это соеди-нение ацилируется по сульфгидрильной группе с образованием соответствующего S‑ацильного производного, например ацетил-кофермента А (СоАS-СОСН3) и снова может переносить ацильные группы на другие молекулы по двум механизмам: с раз-рывом связей С-S- или С-Н в -положении к тиокарбоксилатной группе.
В группе лигаз одно из главных мест принадлежит карбоксилазам, у которых простети-ческая группа представлена биотином или витамином Н:
В молекуле фермента карбоксильной группой биотина ацилирована аминогруппа ос-татка лизина, то есть витамин Н принимает участие в образовании простетической группы. Это достаточно стабильное соединение и авитаминоз по нему встречается только у людей, которые едят много сырых яиц, так как яйца содержат белок, который связывает биотин в прочный комплекс. Бициклический фрагмент биотина с мочевин-ной группировкой присоединен к белковой молекуле на длинном поводке из десяти атомов, что обусловлено необходимостью переноса его с минимальной структурной перестройкой из одного участка фермента в другой, так как механизм его действия основан на двух реакциях. Сначала в одном участке фермента протекает его карбокси-лирование бикарбонатом с участием аденозинтрифосфата:
После этого уже в другом участке фермента карбоксильная группа переносится на дру-гую молекулу, например
Одним из наиболее изучаемых витаминов является витамин С – аскорбиновая кислота, однако ее роль в функционировании ферментов до сих пор не установлена во всех ее проявлениях. Предполагается, что она участвует в образовании входящих в состав кол-лагена (белок соединительной ткани) аминокислот 4-гидроксипролина и 5-гидрокси-лизина и поэтому ее присутствие важно для заживления ран. Не исключено и ее учас-тие в ассимиляции неорганического железа.
Сложное строение отличает группу веществ, называемых витамин В12, чаще всего это цианкобаламин.
Витамин В12 представляет собой кобальторганическое соединение, раствор которого в воде окрашен в пурпурный цвет. Он выполняет роль кофермента изомераз, функционирующих по свободнорадикальному механизму. Источниками кобаламина являются бактерии, в частности бактериальная флора пищеварительного тракта; в растениях он отсутствует. Наиболее ярко авитаминоз по этому фактору про-является в нарушении процесса кроветворения.
Из других обязательных факторов питания можно назвать витамин А или ретинол, витамин Е и витамины группы D и группы К. У витамина А в организме несколько функций. Наиболее известна его роль в зрительном процессе, где он в виде ретиналя, образующегося из ретинола,
участвует в образовании реагирующего на свет пигмента родопсина. Но недостаточ-ность по витамину А не ограничивается только «куриной слепотой», это всего лишь первый симптом авитаминоза по этому веществу. При серьезной недостаточности появляется сухость кожи, глаз (ксерофтальмия), задержка развития и роста, стериль-ность самцов. Но и гипервитаминоз опасен, особенно для беременных женщин.
Витамин Е или токоферол (от гр. токос – потомство, феро – несу)
является ингибитором свободнорадикальных реакций, его недостаток в рационе вызы-вает перерождение репродуктивных органов, нарушение функций мембран, дегенера-цию печени, но точная биологическая роль витамина Е не установлена. Много этого витамина содержится в растительном масле, тем более, что синтетический витамин Е добавляют сейчас в пищевые продукты специально для замедления процессов полиме-ризации и окисления.
Витамины группы D (они, как отмечалось выше, образуются из эргостерина) относятся скорее к гормонам, так как они регулируют обмен кальция и фосфата, а витамин К – замещенный метилнафтохинон – участвует в работе нескольких факторов свертывания крови, правда, коферментная роль его не установлена.
и
Кинетическое описание ферментативных реакций было предложено Михаэлисом и Ментен. В 1913 году эти исследователи предположили, что фермент и субстрат образуют комплекс (ES, комплекс Михаэлиса),
который превращается в комплекс фермента с продуктом превращения субстрата (ЕР), распадающийся далее на фермент и продукт.
Основа катализа – снижение энергии активации реакции, и ферменты по способности снижать ее превосходят все известные катализаторы. Так, например, разложение пер-оксида водорода без катализатора требует энергии активации 18000 кал/моль, самый активный неорганический катализатор – коллоидная платина – снижает ее до 11700 кал/моль, а фермент каталаза обеспечивает снижение энергии активации до величины менее 2000 кал/моль. Сложный эфир – этилбутират – гидролизуется в присутствии кислот с энергией активации 16800 кал/моль, в присутствии щелочей 10200 кал/моль, а панкреатическая липаза характеризуется энергией активации по этому субстрату рав-ной 4500 кал/моль. Очень медленно гидролизуется водой сахароза, в присутствии кислот этот процесс ускоряется (Еа = 25600 кал/моль), а дрожжевая инвертаза снижает этот показатель реакции до 8000-10000 кал/моль. Эта различие в абсолютных вели-чинах выглядит не очень серьезным, но энергия активации в уравнении Аррениуса входит в экспоненциальный множитель
и тогда константа скорости ферментативной реакции (k с индексом е) в логариф-мическом виде представляется уравнением
а константа скорости реакции, катализируемой протонами (индекс h), уравнением
Постоянные реакций Вe и Вh примерно равны и тогда для температуры 37С получаем
что соответствует соотношению ke/kh = 2,51012 (двенадцать порядков!).
Что же лежит в основе уникальной избирательности и высокой каталитической актив-ности ферментов? Прежде всего это особенность пространственного строения белко-вой молекулы, лежащей в основе этих катализаторов. Форма глобулярного белка во многом определяется гидрофобными взаимодействиями между структурными элемен-тами входящих в его состав аминокислот. Эти взаимодействия слабы, но когда их много – они дают серьезный выигрыш в энергии. Гидрофобные структурные элементы заполняют внутреннюю среду белковой глобулы, однако слабость каждого отдельного взаимодействия позволяет белку в ответ на воздействие на внешнюю сферу в резуль-тате изменения рН или присоединения другой молекулы легко перестраиваться, прини-мая новую форму и меняя местами различные функциональные группы боковых цепей аминокислотных фрагментов (сухой и мокрый песок). Еще Э.Фишер выдвинул гипо-тезу о взаимодействии субстрата с активным центром фермента по принципу «ключ-замок». Очень часто и сейчас используют этот подход для схематического изображе-ния ферментативного катализа, но эта схема слишком упрощена, она не отражает того, что в ответ на связывание с субстратом происходит перестройка белковой молекулы фермента, и тогда образующемуся комплексу соответствует минимум энергии уже при ином расположении составляющих фермент структурных элементов, а по мере проте-кания ферментативной реакции такие перестройки могут происходить неоднократно до отхода продукта реакции от реакционного центра.
Первым белком для которого была установлена третичная структура стал миоглобин. Его молекула представляет собой комплекс белка и небелковой гемовой структуры. Биологическая роль миоглобина заключается в транспорте кислорода внутри клетки и в создании запаса кислорода внутри клетки для восполнения его недостатка в экстрен-ных ситуациях. Гемовые структуры присутствуют во многих белках с каталитическими и транспортными функциями. Атом железа, находящийся в центре порфириновой гете-роциклической компоненты гема, может связывать молекулу кислорода или же пере-носить электроны, меняя валентность от +2 до +3 и обратно. В гемоглобинах, предназ-наченных для переноса кислорода, у атома двухвалентного железа с координационным числом равным 6 пять координаций заняты атомами азота: четыре из порфиринового макроцикла, а пятая, в перпендикулярном к плоскости молекулы гема направлении, занята атомом азота из имидазольного цикла фрагмента гистидина, входящего в пеп-тидную цепочку белковой компоненты гемоглобина. Шестая противоположно направ-ленная координация служит для связывания кислорода. Эта связь может заниматься и другими молекулами, так например, монооксид углерода связывается таким гемом в гемоглобине в 200-250 раз прочнее чем кислород.
Рентгеноструктурный анализ кристаллического миоглобина позволил установить его пространственное строение – третичную структуру. Расшифровка структуры прово-дилась в несколько этапов. Сначала на рентгенограмме низкого разрешения было уста-новлено пространственное расположение полипептидной цепи. Затем в результате съемки с более высокой разрешающей способностью была получена рентгенограмма, позволившая установить положение тяжелых атомов, составляющих боковые фраг-менты полипептидной цепи.
Оказалось, что в миоглобине около 80 % всех аминокислотных остатков (всего их 159) включено в -спирали, образующие 8 почти прямолинейных участков, из которых са-мый длинный включает 23 аминокислотных фрагмента, а самый короткий 7. Все четы-ре входящих в состав этого белка молекулы пролина образуют изгиб полипептидной цепи. Все полярные функциональные группы, кроме двух, расположены на наружной поверхности белковой глобулы, а большая часть гидрофобных групп внутри ее. Моле-кула миоглобина настолько компактна, что внутри ее могут поместиться всего лишь четыре молекулы воды. Из различных клеток было выделено несколько разновид-ностей миоглобина, но все они очень близки по форме глобул. Оказалось также, что в некоторых ключевых точках полипептидных цепей разных миоглобинов находятся одинаковые аминокислотные составляющие. Такие аминокислоты называют инвари-антными.
Строение миоглобина, 80 % пептидных фрагментов которого включено в -спирали, определяется его ролью переносчика кислорода. Такая структура с жестким каркасом мало приспособлена для многообразных конформационных переходов. В отличие от этого в молекулах ферментов в -спирали включено обычно не более 40 % аминокис-лотных составляющих, но именно -спирали образуют активные центры ферментов и предназначенные для связывания с другими молекулами участки рецепторов и регуля-торных белков.
Миоглобин не содержит складчатых -структур, но эти элементы третичной структуры белков обязательны для подавляющего большинства ферментов. В качестве примера можно привести защитный белок с гидролазной активностью лизоцим (лизис – раз-рыв, растворение). Он содержится яичном белке, в слезах и в слюне, а его антимик-робная активность основана на расщеплении олигосахаридных фрагментов, участвую-щих в образовании клеточной стенки многих бактерий. В ‑структуры молекулы лизо-цима включено 12 % аминокислотных фрагментов, в -спирали – 40 %, а остальные образуют различные изгибы и иррегулярные витки. Активный центр лизоцима пред-ставлен только -спиралями.
Еще один пример структурной организации – это предназначенный для гидролитичес-кого расщепления рибонуклеиновых кислот фермент рибонуклеаза. Он секретируется клетками поджелудочной железы в двенадцатиперстную кишку и далее поступает в тонкий кишечник. Молекула рибонуклеазы состоит из 124 молекул аминокислот, из них 26 % в составе участков, образующих -спирали, и 35 % находятся в ‑структурах. Нативная конфигурация рибонуклеазы поддерживается четырьмя дисульфидными мостиками.
Одной из главных особенностей ферментов является реализуемая с их помощью воз-можность использования свободной химической энергии, заключенной в таких макро-эргических веществах как аденозинтрифосфат, для осуществления эндотермических реакций, а также синтез аденозинтрифосфата за счет использования энтропийного фак-тора. Однако и без этого ферменты представляют собой уникальные катализаторы.
studfiles.net

